本试题 “硫酸铁(PFS)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理。用铁的氧化物为原料来制取聚合硫酸猴,为控制水解时Fe3+的浓度,防止生成氢氧化铁沉淀,...” 主要考查您对铁盐(三价铁离子)
亚铁盐(二价铁离子)
其他物质的制备(硫酸铜晶体、铁红等)
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 铁盐(三价铁离子)
- 亚铁盐(二价铁离子)
- 其他物质的制备(硫酸铜晶体、铁红等)
Fe3+的性质:
含Fe3+的溶液都呈黄色,具有氧化性,
(1)与还原剂反应生成二价铁 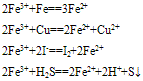
(2)与碱反应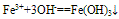
(3)Fe3+在水中易水解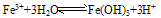
由于三价铁易水解,在保存铁盐盐溶液(FeCl3)时加入少量相应的酸(HCl),以防止Fe3+水解。
“铁三角”中的转化关系:
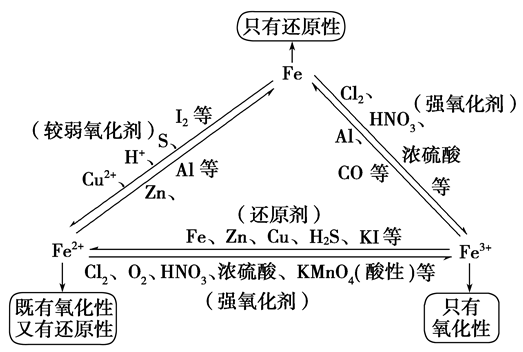
浅绿色溶液,既有氧化性性又具有还原性,主要表现还原性
(1)与氧化剂反应生成三价铁 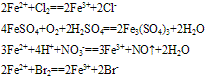
(2)与碱反应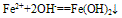
(3)Fe2+易被氧化,水溶液中易水解。亚铁盐溶液(FeCl2)在保存时加入少量铁屑以防止Fe2+被氧化,滴入少量相应的酸溶液(HCl),防止Fe2+水解。
实验室制取甲烷(CH4):
(1)反应原理:CH3COONa+NaOH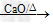 CH4+Na2CO3
CH4+Na2CO3
(2)发生装置:固+固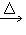 气
气
(3)净化方法:浓硫酸(除水蒸气)
(4)收集方法:排水集气法/向下排空气法
(5)尾气处理:无
(6)检验方法:①点燃,淡蓝色火焰,燃烧产物是H2O和CO2
实验室制取一氧化氮(NO):
(1)反应原理:3Cu+8HNO3(稀)==3Cu(NO3)2+2NO↑+4H2O
(2)发生装置:固+液→气
(3)净化方法:浓硫酸(除水蒸气)
(4)收集方法:排水集气法
(5)尾气处理:收集法(塑料袋)
(6)检验方法:无色气体,暴露于空气中立即变为红棕色
实验室制取二氧化氮(NO2):
(1)反应原理:Cu+4HNO3(浓)==Cu(NO3)2+2NO2↑+2H2O
(2)发生装置:固+液→气
(3)净化方法:浓硫酸(除水蒸气)
(4)收集方法:向上排空气法
(5)尾气处理:碱液吸收 (3NO2+H2O==2HNO3+NO;NO+NO2+2NaOH===2NaNO2+H2O)
实验室制取氯化氢(HCl):
(1)反应原理:2NaCl+H2SO4 Na2SO4+2HCl?
Na2SO4+2HCl?
(2)发生装置:固+液→气
(3)净化方法:浓硫酸(除水蒸气)
(4)收集方法:向上排空气法
(5)尾气处理:水(防倒吸装置)
(6)检验方法:①能使湿润的蓝色石蕊试纸变红 ②靠近浓氨水冒白烟
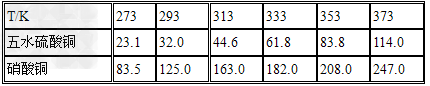
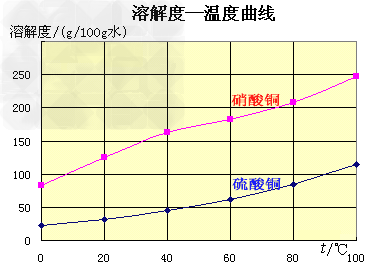
五水硫酸铜的制备:
(1)实验原理:铜是不活泼金属,不能直接和稀硫酸发生反应制备硫酸铜,必须加入氧化剂。在浓硝酸和稀硫酸的混合液中,浓硝酸将铜氧化成Cu2+,Cu2+与SO42-结合得到硫酸铜: Cu+2HNO3+H2SO4====CuSO4+2NO2+2H2O 未反应的铜屑(不溶性杂质)用倾滗法除去。利用硝酸铜的溶解度在0~100℃范围内均大于硫酸铜溶解度的性质,溶液经蒸发浓缩析出硫酸铜,经过滤与可溶性杂质硝酸铜分离,得到粗产品。硫酸铜的溶解度随温度升高而增大,可用重结晶法提纯。在粗产品硫酸铜中,加适量水,加热成饱和溶液,趁热过滤除去不溶性杂质。滤液冷却,析出硫酸铜,过滤,与可溶性杂质分离,得到纯的硫酸铜。
(2)实验步骤
①称量1.5g铜屑,灼烧至表面呈现黑色,冷却;
②加5.5mL3mol/L硫酸,2.5mL浓硝酸,反应平稳后水浴加热,补加2.5mL3mol/L硫酸,0.5mL浓硝酸;
③铜近于完全溶解后,趁热倾滗法分离;
④水浴加热,蒸发浓缩至结晶膜出现;
⑤冷却、过滤;
⑥粗产品以1.2mL水/g的比例,加热溶于水,趁热过滤;
⑦滤液冷却、过滤、晾干,得到纯净的硫酸铜晶体。
⑧称重,计算产率。
实验室制取硫化氢(H2S):
(1)反应原理:FeS+2HCl→H2S↑+FeCl2
(2)发生装置:固+液→气(启普发生器)
(3)净化方法:饱和NaHS(除HCl),固体CaCl2(除水蒸气)
(4)收集方法:向上排空气法
(5)尾气处理:CuSO4溶液或碱液吸收(H2S+2NaOH==Na2S+H2O或H2S+NaOH==NaHS+H2O)
(6)检验方法:①湿润的蓝色石蕊试纸变红 ②湿润的醋酸试纸黑
(1)反应原理:CH3COONa+NaOH
 CH4+Na2CO3
CH4+Na2CO3(2)发生装置:固+固
 气
气 (3)净化方法:浓硫酸(除水蒸气)
(4)收集方法:排水集气法/向下排空气法
(5)尾气处理:无
(6)检验方法:①点燃,淡蓝色火焰,燃烧产物是H2O和CO2
实验室制取一氧化氮(NO):
(1)反应原理:3Cu+8HNO3(稀)==3Cu(NO3)2+2NO↑+4H2O
(2)发生装置:固+液→气
(3)净化方法:浓硫酸(除水蒸气)
(4)收集方法:排水集气法
(5)尾气处理:收集法(塑料袋)
(6)检验方法:无色气体,暴露于空气中立即变为红棕色
实验室制取二氧化氮(NO2):
(1)反应原理:Cu+4HNO3(浓)==Cu(NO3)2+2NO2↑+2H2O
(2)发生装置:固+液→气
(3)净化方法:浓硫酸(除水蒸气)
(4)收集方法:向上排空气法
(5)尾气处理:碱液吸收 (3NO2+H2O==2HNO3+NO;NO+NO2+2NaOH===2NaNO2+H2O)
实验室制取氯化氢(HCl):
(1)反应原理:2NaCl+H2SO4
 Na2SO4+2HCl?
Na2SO4+2HCl?(2)发生装置:固+液→气
(3)净化方法:浓硫酸(除水蒸气)
(4)收集方法:向上排空气法
(5)尾气处理:水(防倒吸装置)
(6)检验方法:①能使湿润的蓝色石蕊试纸变红 ②靠近浓氨水冒白烟
五水硫酸铜的制备:
(1)实验原理:铜是不活泼金属,不能直接和稀硫酸发生反应制备硫酸铜,必须加入氧化剂。在浓硝酸和稀硫酸的混合液中,浓硝酸将铜氧化成Cu2+,Cu2+与SO42-结合得到硫酸铜: Cu+2HNO3+H2SO4====CuSO4+2NO2+2H2O 未反应的铜屑(不溶性杂质)用倾滗法除去。利用硝酸铜的溶解度在0~100℃范围内均大于硫酸铜溶解度的性质,溶液经蒸发浓缩析出硫酸铜,经过滤与可溶性杂质硝酸铜分离,得到粗产品。硫酸铜的溶解度随温度升高而增大,可用重结晶法提纯。在粗产品硫酸铜中,加适量水,加热成饱和溶液,趁热过滤除去不溶性杂质。滤液冷却,析出硫酸铜,过滤,与可溶性杂质分离,得到纯的硫酸铜。


(2)实验步骤
①称量1.5g铜屑,灼烧至表面呈现黑色,冷却;
②加5.5mL3mol/L硫酸,2.5mL浓硝酸,反应平稳后水浴加热,补加2.5mL3mol/L硫酸,0.5mL浓硝酸;
③铜近于完全溶解后,趁热倾滗法分离;
④水浴加热,蒸发浓缩至结晶膜出现;
⑤冷却、过滤;
⑥粗产品以1.2mL水/g的比例,加热溶于水,趁热过滤;
⑦滤液冷却、过滤、晾干,得到纯净的硫酸铜晶体。
⑧称重,计算产率。
实验室制取硫化氢(H2S):
(1)反应原理:FeS+2HCl→H2S↑+FeCl2
(2)发生装置:固+液→气(启普发生器)
(3)净化方法:饱和NaHS(除HCl),固体CaCl2(除水蒸气)
(4)收集方法:向上排空气法
(5)尾气处理:CuSO4溶液或碱液吸收(H2S+2NaOH==Na2S+H2O或H2S+NaOH==NaHS+H2O)
(6)检验方法:①湿润的蓝色石蕊试纸变红 ②湿润的醋酸试纸黑
发现相似题
与“硫酸铁(PFS)是一种新型高效的无机高分子絮凝剂,广泛用于水...”考查相似的试题有:
- 下列反应中,相关示意图象错误的是( )将二氧化硫逐渐通入到一定量氯水中将氨水逐渐滴入到一定量氯化铝溶液中将铜粉逐渐加入...
- 将下列物质溶于稀盐酸后,滴加硫氰化钾(KSCN)溶液没有颜色变化,再加入氯水即呈红色的是( )A.FeB.Fe2O3C.FeCl3D.Fe(...
- 高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂.工业上可以通过次氯酸钠氧化法制备高铁酸钠,生产过程如...
- 现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全...
- 下列反应中,观察不到颜色变化的是( ) A.黄色的氯化铁溶液中加入足量铁粉 B.往稀硫酸中通入氨气 C.往品红溶液中通入足量...
- 实验室制取1 mL乙酸乙酯后,沿壁器加入0.5 mL紫色石蕊试液,这时石蕊试液将存在于饱和碳酸钠层和乙酸乙酯层之间(整个过程不振...
- 实验题(10分)⑴实验室配制500 mL 0.1mol/L的氢氧化钠,请回答下列问题:①称量氢氧化钠固体时应放在 中进行:②配制溶液时应选...
- 氯气是一种重要的化工原料,在生产和生活中应用十分广泛。已知: (浓)="===",在实验室可用二氧化锰固体或高锰酸钾固体和浓盐...
- 某化学实验小组用如图所示的装置制取乙酸乙酯,并检验乙 酸 乙 酯中是否含有乙酸杂质(铁架台、夹子等支撑仪器省略)。已知乙...
- (11分)下图为实验室制取、检验和收集纯净干燥的氯气的实验装置图:(1)装置A的化学方程式为:4HCl(浓)+MnO2 MnCl2+C12↑+2H...