本试题 “单晶硅是信息产业中重要的基础材料。通常用炭在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500℃),四...” 主要考查您对单质硅
其他物质的制备(硫酸铜晶体、铁红等)
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 单质硅
- 其他物质的制备(硫酸铜晶体、铁红等)
硅:
①元素符号:Si
②原子结构示意图: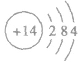
③电子式: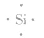
④周期表中位置:第三周期ⅣA族
⑤含量与存在:在地壳中的含量为26.3%,仅次于氧,在自然界中只以化合态存在
⑥同素异形体:晶体硅和无定形硅
硅的物理性质和化学性质:
(1)物理性质:晶体硅是灰黑色,有金属光泽,硬而脆的固体,它的结构类似金刚石,具有较高的沸点和熔点,硬度也很大,它的导电性介于导体和绝缘体之间,是良好的半导体材料。 (2)化学性质:化学性质不活泼
①常温下,除与氟气、氢氟酸及强碱溶液反应外,与其他物质不反应 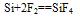
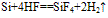 (雕刻玻璃)
(雕刻玻璃)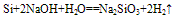
②在加热条件下,能与氧气、氯气等少数非金属单质化合
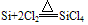
(4)制备:在电炉里用碳还原二氧化硅先制得粗硅: ,将制得的粗硅,再与Cl2反应后,蒸馏出SiCl4,然后用H2还原SiCl4可得到纯硅。有关的反应为:
,将制得的粗硅,再与Cl2反应后,蒸馏出SiCl4,然后用H2还原SiCl4可得到纯硅。有关的反应为: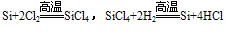 。
。
碳族元素中碳和硅的一些特殊规律:
1.金刚石和晶体硅都是原子晶体,但金刚石不导电,晶体硅能导电.且金刚石的熔点(大于3550℃)比硅的熔点(1410℃)高;石墨是过渡型晶体或混合型晶体,也能导电。
2.碳和硅都能跟O2反应生成氧化物,碳的两种氧化物CO和CO2在常温下是气体,而硅的氧化物SiO2 在常温下是固体。
3.碳跟碱溶液不反应,而硅跟碱溶液能反应。
Si+2NaOH+H2O==Na2SiO3+2H2↑
4.碳在高温时能跟水蒸气反应,而硅不能。
C+H2O(g) CO+H2
CO+H2
5.碳跟氢氟酸不反应,而硅能跟氢氟酸反应。
Si+4HF==SiF4↑+2H2↑
6.碳能被浓硫酸(或浓硝酸)氧化生成二氧化碳,但硅不能被浓硫酸(或浓硝酸)氧化。
C+2H2SO4(浓) CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
C+4HNO3(浓) 4NO2↑+2H2O+CO2↑
4NO2↑+2H2O+CO2↑
7.碳和硅都具有还原性,且硅的还原性比碳强,但在高温时碳能把硅从SiO2中还原出来。
2C+SiO2 Si+2CO↑
Si+2CO↑
8.碳的氯化物都不能自燃,而SiH4能自燃。
SiH4+2O2==SiO2+2H2O
9.通常情况下,周态CO、CO2都是分子晶体,熔、沸点都很低;而SiO2是原子晶体,熔、沸点较高。
10.CO2溶于水且能跟水反应生成碳酸,SiO2却不能.
11.CO2跟氢氟酸不反应,而SiO2能跟氢氟酸反应.
SiO2+4HF==SiF4↑+2H2O
12.CO2跟碱溶液反嘘生成正盐或酸式盐,而SiO2 跟碱溶液反应只生成正盐。
CO2+2NaOH==Na2CO3+H2O
CO2+NaOH==NaHCO3
SiO2+2NaOH==Na2SiO3+H2O
13.在溶液中Na2SiO3可转变为Na2CO3,而在高温条件下Na2CO3又可转变为Na2SiO3。
Na2SiO3+CO2+H2O==Na2CO3+H2SiO3↓
Na2CO3+SiO2 Na2SiO3+CO2↑
Na2SiO3+CO2↑
硅及其化合物的几种反常现象:
1.Si的还原性大于C,但C却能在高温下还原出Si 可从平衡移动的角度理解,由于高温下生成了气态物质CO2它的放出降低了生成物的浓度,有利于应反正向进行,故可发生反应:SiO2+2C Si+2CO↑
Si+2CO↑
2.部分非金属单质能与碱溶液反应,但其中只有 Si与碱反应放出H2 常见的非金属单质与碱溶液的反应有:
Cl2+2NaOH==NaCl+NaClO+H2O①
3S+6NaOH 2Na2S+Na2SO3+3H2O②
2Na2S+Na2SO3+3H2O②
Si+2NaOH+H2O==Na2SiO3+2H2↑③
在反应①②中,Cl2、S既作氧化剂又作还原剂:在反应③中,Si为还原剂。
3.非金属单质一般不与弱氧化性酸反应,而硅不但能与氢氟酸反应,而且还会产生H2
4.硅酸不能由相应的酸酐与水反应制得制取硅酸的实际过程很复杂,条件不同可得到不同的产物,通常包括原硅酸(H2SiO4)及其脱水得到的一系列酸。原硅酸经两步脱水变为SiO2,SiO2是硅酸的酸酐,是一种不溶于水的同体,不能直接用它制备硅酸,用SiO2制取硅酸时,可先将SiO2溶于烧碱中,再向溶液中加入足量的盐酸或通入过量的CO2,析出的胶状物就是原硅酸,将原硅酸在空气中脱水即得硅酸,反应原理可理解为:
SiO2+2NaOH==Na2SiO3+H2O
Na2SiO3+CO2+2H2O==Na2CO3+H4SiO4↓
H4SiO4==H2SiO3+H2O
5.非金属氧化物的熔沸点一般较低,但SiO2的熔沸点却很高非金属氧化物一般为分子晶体,但SiO2为原子晶体。分子晶体中分子以分子问作用力相结合,而分子间作用力很弱,破坏它使晶体变为液体或气体比较容易;而在SiO2晶体中每个硅原子与四个氧原子相结合,形成硅氧四面体,在每个硅氧四面体结构单元中Si—O 键的键能很高,同时硅氧四面体结构单元可通过共用顶角氧原子连成立体网状结构,所以要使它熔融,必须消耗更多的能量,因此SiO2的熔沸点很高。
6.SiO2是酸性氧化物却能跟HF作用
SiO2+4HF==SiF4↑+2H2O,此反应并不是因为HF的酸性,而是因为为常温下SiF4为气态物质,有利于反应正向进行,这是SiO2的突出特性,当然也是HF 的特性。
7.H2CO3的酸性强于H2SiO3。但却能发生如下反应:Na2CO3+SiO2 Na2SiO3+CO2↑
Na2SiO3+CO2↑
强酸制备弱酸作为判断反应方向的依据,只适用于水溶液体系,而在非水溶液的条件下不一定适用,在高温下能发生反应:Na2CO3+SiO2 Na2SiO3+ CO2↑的原因是H2SiO3难挥发,H2CO3易挥发,这符合高沸点物质制低沸点物质的反应规律,与此反应类似的还有:
Na2SiO3+ CO2↑的原因是H2SiO3难挥发,H2CO3易挥发,这符合高沸点物质制低沸点物质的反应规律,与此反应类似的还有:
2NaCl+H2SO4(浓) Na2SO4+2HCl↑
Na2SO4+2HCl↑
NaNO3+H2SO4(浓) NaHSO4+HNO3↑
NaHSO4+HNO3↑
上述两反应并不是由于H2SO4的强酸性,而是由于H2SO4为高沸点酸,HCl、HNO3为低沸点酸。
硅的用途:
高纯硅可作半导体材料,制造集成电路、晶体管、硅整流器等半导体器件,还可以制造太阳能电池。硅的合金用途也很广,如含硅4%的钢具有良好的导磁性,可用来制造变压器的铁芯;含硅15%左右的钢具有良好的耐酸性,可用来制造耐酸设备。
(1)反应原理:CH3COONa+NaOH
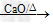 CH4+Na2CO3
CH4+Na2CO3(2)发生装置:固+固
 气
气 (3)净化方法:浓硫酸(除水蒸气)
(4)收集方法:排水集气法/向下排空气法
(5)尾气处理:无
(6)检验方法:①点燃,淡蓝色火焰,燃烧产物是H2O和CO2
实验室制取一氧化氮(NO):
(1)反应原理:3Cu+8HNO3(稀)==3Cu(NO3)2+2NO↑+4H2O
(2)发生装置:固+液→气
(3)净化方法:浓硫酸(除水蒸气)
(4)收集方法:排水集气法
(5)尾气处理:收集法(塑料袋)
(6)检验方法:无色气体,暴露于空气中立即变为红棕色
实验室制取二氧化氮(NO2):
(1)反应原理:Cu+4HNO3(浓)==Cu(NO3)2+2NO2↑+2H2O
(2)发生装置:固+液→气
(3)净化方法:浓硫酸(除水蒸气)
(4)收集方法:向上排空气法
(5)尾气处理:碱液吸收 (3NO2+H2O==2HNO3+NO;NO+NO2+2NaOH===2NaNO2+H2O)
实验室制取氯化氢(HCl):
(1)反应原理:2NaCl+H2SO4
 Na2SO4+2HCl?
Na2SO4+2HCl?(2)发生装置:固+液→气
(3)净化方法:浓硫酸(除水蒸气)
(4)收集方法:向上排空气法
(5)尾气处理:水(防倒吸装置)
(6)检验方法:①能使湿润的蓝色石蕊试纸变红 ②靠近浓氨水冒白烟
五水硫酸铜的制备:
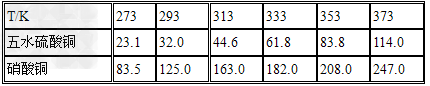
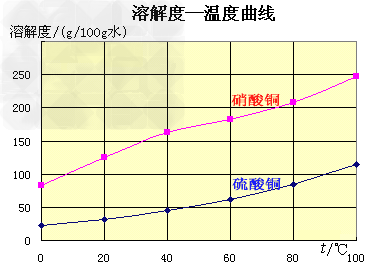
(1)实验原理:铜是不活泼金属,不能直接和稀硫酸发生反应制备硫酸铜,必须加入氧化剂。在浓硝酸和稀硫酸的混合液中,浓硝酸将铜氧化成Cu2+,Cu2+与SO42-结合得到硫酸铜: Cu+2HNO3+H2SO4====CuSO4+2NO2+2H2O 未反应的铜屑(不溶性杂质)用倾滗法除去。利用硝酸铜的溶解度在0~100℃范围内均大于硫酸铜溶解度的性质,溶液经蒸发浓缩析出硫酸铜,经过滤与可溶性杂质硝酸铜分离,得到粗产品。硫酸铜的溶解度随温度升高而增大,可用重结晶法提纯。在粗产品硫酸铜中,加适量水,加热成饱和溶液,趁热过滤除去不溶性杂质。滤液冷却,析出硫酸铜,过滤,与可溶性杂质分离,得到纯的硫酸铜。
(2)实验步骤
①称量1.5g铜屑,灼烧至表面呈现黑色,冷却;
②加5.5mL3mol/L硫酸,2.5mL浓硝酸,反应平稳后水浴加热,补加2.5mL3mol/L硫酸,0.5mL浓硝酸;
③铜近于完全溶解后,趁热倾滗法分离;
④水浴加热,蒸发浓缩至结晶膜出现;
⑤冷却、过滤;
⑥粗产品以1.2mL水/g的比例,加热溶于水,趁热过滤;
⑦滤液冷却、过滤、晾干,得到纯净的硫酸铜晶体。
⑧称重,计算产率。
实验室制取硫化氢(H2S):
(1)反应原理:FeS+2HCl→H2S↑+FeCl2
(2)发生装置:固+液→气(启普发生器)
(3)净化方法:饱和NaHS(除HCl),固体CaCl2(除水蒸气)
(4)收集方法:向上排空气法
(5)尾气处理:CuSO4溶液或碱液吸收(H2S+2NaOH==Na2S+H2O或H2S+NaOH==NaHS+H2O)
(6)检验方法:①湿润的蓝色石蕊试纸变红 ②湿润的醋酸试纸黑
与“单晶硅是信息产业中重要的基础材料。通常用炭在高温下还原二...”考查相似的试题有:
- 淀粉的分子式为______,它遇碘水会______用于制造光导维的材料______ (写化学式).
- 下列所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是[ ]abcA.Al AlCl3Al(OH)3B.HNO3 NONO2C.Si SiO2H2SiO3...
- 下列说法中正确的是( )A.溶液是电中性的,胶体是带电的B.SiO2是将太阳能转化为电能的常用材料C.原电池中盐桥的作用之一...
- 垃圾是放错地方的资源,工业废料也可以再利用。某化学兴趣小组在实验室中用废弃含有铝、铁、铜的合金制取硫酸铝溶液、硝酸铜...
- (12分)为除去粗盐中的Ca2+、Mg2+、SO以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过...
- 下列气体中,不能用排空气收集的是 ( )A.NOB.NH3C.CO2D.H2
- 二氧化碳是一种无色无味的气体,密度比空气大,可溶于水。通常实验室可以用碳酸钙(固体)和稀盐酸溶液来制取。如果是你要利...
- (1)用18mol·L-1的硫酸配制1.00 mol·的硫酸100mL。若实验仪器有:A.100mL量筒、B.托盘天平、C.玻璃棒、D.50mL容器瓶、E. 10m...
- 已知NH3极易溶于水,难溶于有机溶剂,下列装置宜用于NH3尾气吸收的是
- 科学研究发现纳米级的Cu2O可作为太阳光分解水的催化剂。I.四种制取Cu2O的方法:(1)火还原法:用炭粉在高温条件下还原CuO。(2...