本试题 “某芳香烃X是一种重要的有机化工原料,它的相对分子质量为92。研究部门以X为初始原料设计出如下转化关系图(部分产物、合成路线、反应条件略去),其中A是一氯...” 主要考查您对醇的通性
酯
有机物的合成
结构简式
同分异构体
有机物的推断
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 醇的通性
- 酯
- 有机物的合成
- 结构简式
- 同分异构体
- 有机物的推断
醇:
醇的定义:羟基跟烃基或苯环侧链上的碳原子直接相连的化合物叫做醇。
说明:在同一个碳原子上存在两个或多个羟基的多元醇,羟基连在碳碳双键或碳碳三键的不饱和碳原子上的醇,都不能稳定存在。
醇的性质:
1.醇的物理性质饱和一元醇的沸点比其相对分子质量接近的烷烃或烯烃的沸点高。这是因为一个醇分子中羟基上的氢原子可与另一个醇分子中羟基上的氧原子相互吸引形成氢键,增强了醇分子间的相互作用。
2.醇的化学性质
(1)羟基的反应
①取代反应
在加热的条件下,醇与氢卤酸(如HCl、HBr、HI)发生取代反应生成相应的卤代烃和水,例如: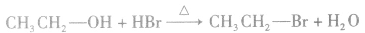
在浓硫酸作催化剂及加热的条件下,醇可以发生分子间的取代反应生成醚和水,例如: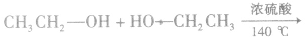
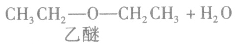
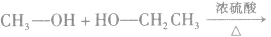

说明a.由醇生成醚的反应又叫做脱水反应或分子间脱水反应。
b.在醇生成醚的反应中,浓硫酸的作用是作催化剂和脱水剂。温度是醇脱水生成醚的必要条件之一,若温度过低,反应速率很慢或不能反应;若温度过高,反应会生成其他物质。
②消去反应
含β—H的醇,在一定条件下发生消去反应生成烯烃和水,例如:
说明a.由醇生成烯烃的反应又叫做脱水反应或分子内脱水反应。
b.从分子组成与结构的方面来说,脱水生成烯烃的醇分子必须含有β一H,如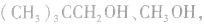 由于分子中没有β—H,不能脱水生成烯烃。
由于分子中没有β—H,不能脱水生成烯烃。
c.在醇生成烯烃的反应中,浓硫酸的作用是作催化剂和脱水剂。
d.人们通常把和官能团相连的碳原子称为α一C 原子.α—C原子上的氢原子称为α—H原子;依次称为β一C原子,β—H原子……
(2)羟基中氢原子的反应
①与活泼金属反应
由于氧元素与氢元素电负性的差异较大,羟基中氢氧键的极性比较强,容易断裂,所以羟基中的氢原子比较活泼,能与钠、钾、镁、铝等金属发生反应。例如,乙醇可以与金属钠反应生成乙醇钠和氢气。
②酯化反应
在一定条件下,醇羟基中的氢原子能够被羧酸分子中的酰基( )取代生成酯和水。
)取代生成酯和水。
例如: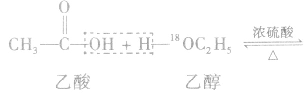

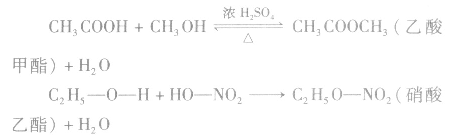
说明a.该类反应由于生成了酯,所以叫做酯化反应。从物质分子组成形式变化的角度来说,该反应又属于取代反应。
b.在乙醇与乙酸生成乙酸乙酯的反应中,利用氧同位素(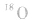 )示踪法对乙醇分子中的氧原子进行标记,通过对生成物的检测,发现产物乙酸乙酯中含有氧的同位素(
)示踪法对乙醇分子中的氧原子进行标记,通过对生成物的检测,发现产物乙酸乙酯中含有氧的同位素(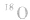 )。这说明,酯化反应中脱掉羟基的是羧酸,脱掉氢原子的是醇。
)。这说明,酯化反应中脱掉羟基的是羧酸,脱掉氢原子的是醇。
c.醇跟羧酸发生的酯化反应为可逆反应,具有反应速率慢和向右进行程度小的特点。加入浓硫酸的目的(浓硫酸的作用)有两个:一是作催化剂,提高化学反应速率;二是作吸水剂,通过吸收反应生成的水促使反应向生成乙酸乙酯的方向移动,提高乙酸与乙醇的转化率。
d.醇还能与硫酸、硝酸、磷酸等无机含氧酸发生酯化反应,生成的酯统称为无机酸酯。
(3)氧化反应大多数醇可以燃烧,完全燃烧时生成二氧化碳和水。醇也可以被催化氧化。例如: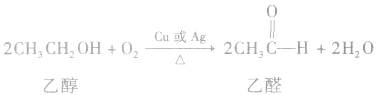
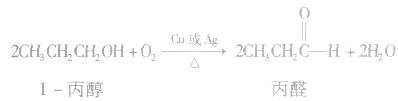
说明a.在醇的催化氧化反应中,醇分子中有2 个α一H时,醇被氧化为醛;醇分子中有1个α—H时,醇被氧化为酮;醇分子中没有α一H时,醇不能发生上述催化氧化反应。
b.乙醇也能被KMnO4酸性溶液、K2Cr2O7(重铬酸钾)酸性溶液氧化。
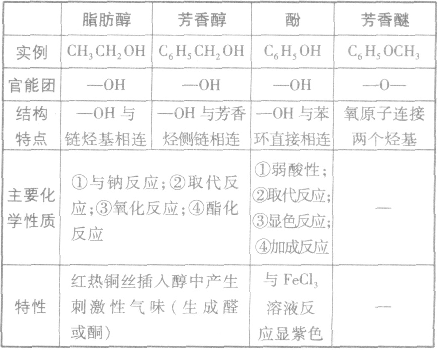
脂肪醇、芳香醇、酚和芳香醚的比较:
羟基氢原子活泼性比较:
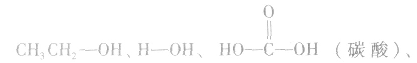
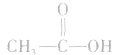 均有羟基,南于这些羟基连接的基团不同,羟基上氢原子的活泼性也就不同,现比较如下:
均有羟基,南于这些羟基连接的基团不同,羟基上氢原子的活泼性也就不同,现比较如下: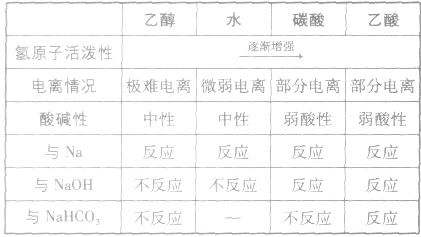
1.概念及通式:
酸(羧酸或无机含氧酸)和醇起反应生成的一类化合物叫酯。如:
酯的通式为
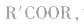 官能团是
官能团是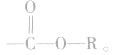 饱和一元羧酸和饱和一元醇形成的酯的通式为
饱和一元羧酸和饱和一元醇形成的酯的通式为 (n≥2),所以这种酯与碳原子数相同的饱和一元羧酸及羟基醛互为同分异构体,与多1个碳原子的饱和一元醇的相对分子质量相等。
(n≥2),所以这种酯与碳原子数相同的饱和一元羧酸及羟基醛互为同分异构体,与多1个碳原子的饱和一元醇的相对分子质量相等。2.分类
根据生成酯的酸的不同,酯可分为有机酸酯和无机酸酯,通常所说的酯是指有机酸(羧酸)酯。
3.书写及命名——某酸某酯
根据生成酯的酸和醇对酯进行命名:如:

4.酯的存在酯类广泛存在于自然界中,如苹果里含有戊酸戊酯,香蕉里含有乙酸异戊酯等。
酯的性质:
1.酯的物理性质
低级酯是具有芳香气味的液体,密度一般小于水,并难溶于水,易溶于有机溶剂。
2.酯的化学性质
在酸或碱催化的条件下,酯可以发生水解反应,能得到相应的酸和醇。酯在酸性条件下的水解反应是可逆反应。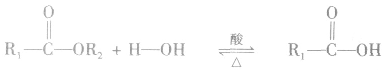
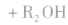
酯在碱性条件下的水解程度大于在酸性条件下的水解程度,其主要原因是在碱性条件下,酯水解生成的羧酸可以与碱发生反应,使羧酸浓度减小,即减小了生成物的浓度,化学平衡向正反应方向移动,使酯的水解程度增大。
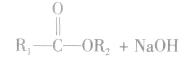
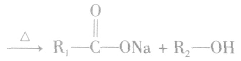
3.酯的用途酯具有广泛的用途。很多香精、药物本身就是酯。例如,广泛用于农业生产和家庭除虫的低毒高效杀虫药拟除虫菊酯就是一种酯,某些抗生素如红霉素为大环内酯类抗生素,也属于酯。日常生活中的饮料、糖果和糕点等常使用酯类物质作为香料。液态的酯可用作有机溶剂。
酯化反应的规律归纳:
1.酯化反应中量的变化
(1)酯化反应发生时,每有1mol酯基“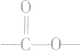 ”生成,必生成1molH2O。根据质量守恒有:反应物巾各元素原子数=生成物中各元素原子数;m(酸)+m(醇)=m(酯)+m(H2O)。
”生成,必生成1molH2O。根据质量守恒有:反应物巾各元素原子数=生成物中各元素原子数;m(酸)+m(醇)=m(酯)+m(H2O)。
2.酯化反应前后碳链结构的变化规律
在下列一系列变化中,分子中的碳链结构不变:醇 醛
醛 羧酸
羧酸 酯,酯键两侧的碳骨架仍保持着醇的碳架和羧酸的碳架。醇与它自身氧化成的羧酸反应生成的酯,酯键两侧碳骨架相同。
酯,酯键两侧的碳骨架仍保持着醇的碳架和羧酸的碳架。醇与它自身氧化成的羧酸反应生成的酯,酯键两侧碳骨架相同。
3.酯化反应的反应条件
酯化反应是可逆反应,逆反应是酯的水解。羧酸和醇的酯化反应速率很慢,冈此,酯化反应通常要在加热并加催化剂(浓硫酸)的条件下进行。之所以用浓硫酸而不用稀硫酸是因为浓硫酸除起催化作用外,还可作吸水剂吸收酯化反应生成的水,有利于反应向生成酯的方向进行。酯化反应巾的浓硫酸,可用浓磷酸
有机合成过程主要包括两个方面,
其一是碳原子骨架的变化,例如碳链的增长和缩短、链状和环状的互相转化;
其二是官能团的引入和消除、官能团的衍变等变化。
解答有机物的合成相关题目的方法:
考查有机合成实质是根据有机物的性质,进行必要的官能团反应,从而达到考查官能团性质的目的。因此,要想熟练解答此类问题,须掌握如下知识:
(1)官能团的引入:
在有机化学中,卤代烃可谓烃及烃的衍生物的桥梁,只要能得到卤代烃,就可能得到诸如含有羟基、醛
基、羧基、酯基等官能团的物质。此外,由于卤代烃可以和醇类相互转化,因此在有机合成中,如果能引入羟
基,也和引入卤原子的效果一样,其他有机物都可以信手拈来。同时引入羟基和引入双键往往是改变碳原子骨
架的终南捷径,因此官能团的引入着重总结羟基、卤原子、双键的引入。
①引入羟基(-OH)
A. 醇羟基的引入:烯烃与水加成、卤代烃水解、醛(酮)与氢气的加成、酯的水解等。
B. 酚羟基的引入:酚钠盐过渡中通入CO2,
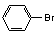 的碱性水解等。
的碱性水解等。 C. 羧羟基的引入:醛氧化为酸(被新制Cu(OH)2悬浊液或银氨溶液氧化)、酯的水解等。
②引入卤原子:烃与卤素取代、不饱和烃与HX或X2加成、醇与HX取代等。
③引入双键:某些醇或卤代烃的消去引入C=C键、醇的氧化引入C=O键等。
(2)官能团的消除:
①通过加成消除不饱和键。
②通过消去、氧化或酯化等消除羟基(-OH)
③通过加成或氧化等消除醛基(-CHO)
(3)官能团间的衍变: 可根据合成需要(或题目中所给衍变途径的信息),进行有机物官能团的衍变,以使中间物向产物递进。常见方式有以下三种:
①利用官能团的衍生关系进行衍变:如以丙烯为例,看官能团之间的转化:

上述转化中,包含了双键、卤代烃、醇、醛、羧酸、酯高分子化合物等形式的关系,领会这些关系,基本可
以把常见的有机合成问题解决。
②通过某种化学途径使一个官能团变为两个,如
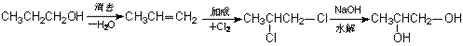
③通过某种手段,改变官能团的位置:如:
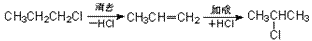
(4)碳骨架的变化:
①碳链增长:若题目中碳链增长,课本中目前的知识有:酯化反应、氨基缩合反应、不饱和结构与HCN的加
成反应、不饱和化合物间的聚合,此外常由信息形式给出,例如羟醛缩合反应、卤代烃与金属钠反应等。
例如:

②碳链变短:碳链变短的形式有烃的裂化裂解,某些烃(如烯烃、苯的同系物)的氧化、羧酸及盐的脱羧反应等。
例如:
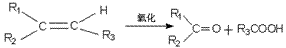
③链状变环状:不饱和有机物之间的加成,同一分子中或不同分子中两个官能团互相反应结合成环状结构。
例如,-OH与-OH间的脱水、羧基和羟基之间的反应、氨基和羧基之间的反应等。
④环状变链状:酯及多肽的水解、环烯的氧化等。当然,掌握上述相关知识后,还要分析要合成的有机物的结构,对比官能团与所给原料的官能团的异同,展开联想,理清衍变关系。同时深入理解并充分运用新信息要注意新信息与所要求合成的物质间的联系,找出
其结合点或共同性质,有时根据需要还应从已知信息中通过对比、分析、联想,开发出新的信息并加以利用。
结构式的简便写法,着重突出结构特点(官能团),如CH3-CH3,CH2=CH2
同分异构现象和同分异构体:
1.概念:化合物具有相同的分子式.但结构小同,因而产生了性质上的差异,这种现象叫同分异构现象。具有同分异构现象的化合物互为同分异构体。
2.同分异构体的基本类型
(1)碳链异构:指的是分子中碳骨架不同而产生的同分异构现象。如所有的烷烃异构都属于碳链异构。
(2)位置异构:指的是分子中官能团位置不同而产生的同分异构现象。如l一丁烯与2一丁烯、l一丙醇与2一丙醇、邻二甲苯与间二甲苯及对二甲苯。
(3)官能团异构:指的是有机物分子式相同,但具有不同官能团的同分异构体的现象。常见的官能团异构关系如下表所示: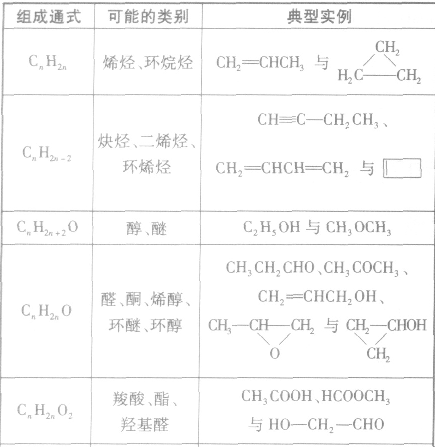
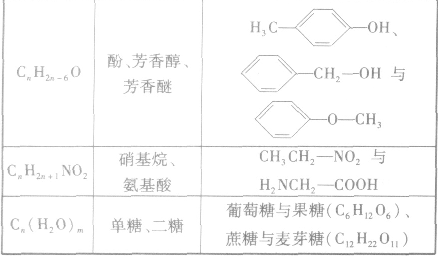
(4)顺反异构:由于碳碳双键不能旋转而导致分子中原子或原子团在空间的排列方式不同所产生的异构现象。两个相同的原子或原子团排列在双键的同一侧的称为顺式结构;两个相同的原子或原子团排列在双键的两侧的称为反式结构。如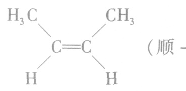
同分异构体的写法:
1.烷烃的同分异构体的写法烷烃只存在碳链异构,其书写技巧一般采用“减碳法”,可概括为“两注意,四句话”。
(1)两注意:①选择最长的碳链为主链;②找出主链的中心对称线。
(2)四句话:主链由长到短、支链由整到散,位置由心到边,排布邻、间、对。
例如,C6H14的同分异构体可按此法完整写出(为了简便,在所写结构式中删去了氢原子): 
2.烯烃的同分异构体的写法分子组成符合CnH2n的烃除烯烃外,还有环烷烃 (n≥3),并且烯烃中双键的位置不同则结构不同,有的烯烃还存在顺反异构,所以烯烃的同分异构体比烷烃复杂得多。以C5H10为例说明同分异构体的写法: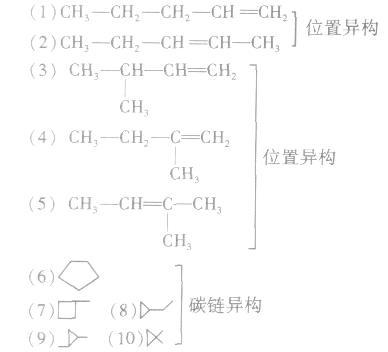
共有5种烯烃,其中(2)还存在顺反异构体,5种环烷烃,共计11种。
3.苯的同系物的同分异构体的写法由于苯环上的侧链位置不同,可以形成多种同分异构体。以C8H10为例写出其属于苯的同系物的同分异构体:
判断同分异构体数目的方法:
1.碳链异构和位置异构:先摘除官能团,书写最长碳链,移动官能团的位置;再逐渐减少碳数,移动官能团的位置。判断分子式为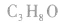 的醇的同分异构体数目:
的醇的同分异构体数目:
先摘除官能团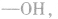 剩余
剩余 和
和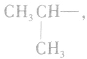 可见有两种属于醇的同分异构体;
可见有两种属于醇的同分异构体;
判断分子式为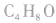 的属于醛的同分异构体数目:
的属于醛的同分异构体数目:
先摘除官能团 剩余
剩余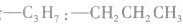 和
和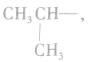 可见有两种属于醛的同分异构体。
可见有两种属于醛的同分异构体。
分子式符合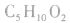 的羧酸的同分异构体数目:
的羧酸的同分异构体数目:
先摘除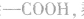 剩余
剩余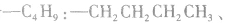
 可 见有4种属于酸的同分异构体。
可 见有4种属于酸的同分异构体。
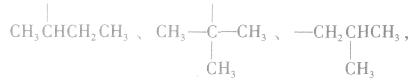
2.官能团衍变:先判断官能团的类别异构,再分别判断同种官能团的异构数目。例如分子式符合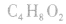 的同分异构体:符合羧酸和酯的通式,属于酸的2种(即摘除
的同分异构体:符合羧酸和酯的通式,属于酸的2种(即摘除 后剩余
后剩余 ),这样一个羧基又可以变为一个醛基和一个羟基,又可以衍变出含有两种不同含氧官能团(含有羟基和醛基)的异构体;属于酯的同分异构体:可以按羧酸和醇的碳数先分类,即酯由一个碳的酸(甲酸)和3个碳的醇(1一丙醇、2一丙醇)得到,酯由2个碳的酸(乙酸)和2个碳的醇(乙醇)得到,酯由3个碳数的酸(丙酸)和1个碳的醇(甲醇)得到,这样就会写出4种酯。
),这样一个羧基又可以变为一个醛基和一个羟基,又可以衍变出含有两种不同含氧官能团(含有羟基和醛基)的异构体;属于酯的同分异构体:可以按羧酸和醇的碳数先分类,即酯由一个碳的酸(甲酸)和3个碳的醇(1一丙醇、2一丙醇)得到,酯由2个碳的酸(乙酸)和2个碳的醇(乙醇)得到,酯由3个碳数的酸(丙酸)和1个碳的醇(甲醇)得到,这样就会写出4种酯。
3.苯环上的位置变换:例如分子式符合 的芳香酯的同分异构体:
的芳香酯的同分异构体: 
4.判断取代产物种类(“一”取代产物:对称轴法; “多”取代产物:一定一动法;数学组合法)。
5.替代法:例如二氯苯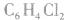 有3种,则四氯苯也为3种(将H替代C1);又如CH4的一氯代物只有一种,新戊烷C(CH3)4的一氯代物也只有一种。
有3种,则四氯苯也为3种(将H替代C1);又如CH4的一氯代物只有一种,新戊烷C(CH3)4的一氯代物也只有一种。
6.对称法(又称等效氢法):等效氢法的判断可按下列三点进行:
(1)同一碳原子上的氢原子是等效的;
(2)同一碳原子所连甲基上的氢原子是等效的;
(3)处于镜面对称位置上的氢原子是等效的(相当于平面成像时,物与像的关系)。
烃的一取代物的数目等于烃分子中等效氢的种数。
①找已知条件最多的,信息量最大的。这些信息可以是化学反应、有机物性质(包括物理性质)、反应条件、实验现象、官能团的结构特征、变化前后的碳链或官能团间的差异、数据上的变化等等。
②寻找特殊的或唯一的。包括具有特殊性质的物质(如常温下处于气态的含氧衍生物--甲醛)、特殊的分子式(这种分子式只能有一种结构)、特殊的反应、特殊的颜色等等。
③根据数据进行推断。数据往往起突破口的作用,常用来确定某种官能团的数目。
④根据加成所需
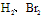 的量,确定分子中不饱和键的类型及数目;由加成产物的结构,结合碳的四价确定不饱和键的位置。
的量,确定分子中不饱和键的类型及数目;由加成产物的结构,结合碳的四价确定不饱和键的位置。 ⑤如果不能直接推断某物质,可以假设几种可能,结合题给信息进行顺推或逆推,猜测可能,再验证可能,看是否完全符合题意,从而得出正确答案。
推断有机物,通常是先通过相对分子质量,确定可能的分子式。再通过试题中提供的信息,判断有机物可能存在的官能团和性质。最后综合各种信息,确定有机物的结构简式。其中,最关键的是找准突破口。
根据反应现象推知官能团:
①能使溴水褪色,可推知该物质分子中可能含有碳碳双键、三键或醛基。
②能使酸性高锰酸钾溶液褪色,可推知该物质分子中可能含有碳碳双键、三键、醛基或为苯的同系物。
③遇三氯化铁溶液显紫色,可推知该物质分子含有酚羟基。
④遇浓硝酸变黄,可推知该物质是含有苯环结构的蛋白质。
⑤遇I2水变蓝,可推知该物质为淀粉。
⑥加入新制氢氧化铜悬浊液,加热,有红色沉淀生成;或加入银氨溶液有银镜生成,可推知该分子结构有-CHO即醛基。则该物质可能为醛类、甲酸和甲酸某酯。
⑦加入金属Na放出H2,可推知该物质分子结构中含有-OH或-COOH。
⑧加入NaHCO3溶液产生气体,可推知该物质分子结构中含有-COOH或-SO3H。
⑨加入溴水,出现白色沉淀,可推知该物质为苯酚或其衍生物。
根据物质的性质推断官能团:
能使溴水褪色的物质,含有C=C或C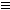 C或-CHO;能发生银镜反应的物质,含有-CHO;能与金属钠发生置换反应的物质,含有-OH、-COOH;能与碳酸钠作用的物质,含有羧基或酚羟基;能与碳酸氢钠反应的物质,含有羧基;能水解的物质,应为卤代烃和酯,其中能水解生成醇和羧酸的物质是酯。但如果只谈与氢氧化钠反应,则酚、羧酸、卤代烃、苯磺酸和酯都有可能。能在稀硫酸存在的条件下水解,则为酯、二糖或淀粉;但若是在较浓的硫酸存在的条件下水解,则为纤维素。
C或-CHO;能发生银镜反应的物质,含有-CHO;能与金属钠发生置换反应的物质,含有-OH、-COOH;能与碳酸钠作用的物质,含有羧基或酚羟基;能与碳酸氢钠反应的物质,含有羧基;能水解的物质,应为卤代烃和酯,其中能水解生成醇和羧酸的物质是酯。但如果只谈与氢氧化钠反应,则酚、羧酸、卤代烃、苯磺酸和酯都有可能。能在稀硫酸存在的条件下水解,则为酯、二糖或淀粉;但若是在较浓的硫酸存在的条件下水解,则为纤维素。
(4)根据特征数字推断官能团
①某有机物与醋酸反应,相对分子质量增加42,则分子中含有一个-OH;增加84,则含有两个-OH。缘由-OH转变为
-OOCCH3。
②某有机物在催化剂作用下被氧气氧化,若相对分子质量增加16,则表明有机物分子内有一个-CHO(变为-COOH);若增加32,则表明有机物分子内有两个-CHO(变为-COOH)。
③若有机物与Cl2反应,若有机物的相对分子质量增加71,则说明有机物分子内含有一个碳碳双键;若增加142,则说明有机物分子内含有二个碳碳双键或一个碳碳叁键。
根据反应产物推知官能团位置:
①若由醇氧化得醛或羧酸,可推知-OH一定连接在有2个氢原子的碳原子上,即存在-CH2OH;由醇氧化为酮,推知-OH一定连在有1个氢原子的碳原子上,即存在 ;
;
若醇不能在催化剂作用下被氧化,则-OH所连的碳原子上无氢原子。
②由消去反应的产物,可确定-OH或-X的位置
③由取代反应产物的种数,可确定碳链结构。如烷烃,已知其分子式和一氯代物的种数时,可推断其可能的结构。有时甚至可以在不知其分子式的情况下,判断其可能的结构简式。
④由加氢后碳链的结构,可确定原物质分子C=C或C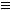 C的位置。
C的位置。
根据反应产物推知官能团的个数:
①与银氨溶液反应,若1mol有机物生成2mol银,则该有机物分子中含有一个醛基;若生成4mol银,则含有二个醛基或该物质为甲醛。
②与金属钠反应,若1mol有机物生成0.5molH2,则其分子中含有一个活泼氢原子,或为一个醇羟基,或酚羟基,也可能为一个羧基。
③与碳酸钠反应,若1mol有机物生成0.5molCO2,则说明其分子中含有一个羧基。
④与碳酸氢钠反应,若1mol有机物生成1molCO2,则说明其分子中含有一个羧基。
根据反应条件推断反应类型:
①在NaOH水溶液中发生水解反应,则反应可能为卤代烃的水解反应或酯的水解反应。
②在氢氧化钠的醇溶液中,加热条件下发生反应,则一定是卤代烃发生了消去反应。
③在浓硫酸存在并加热至170℃时发生反应,则该反应为乙醇的消去反应。
④能与氢气在镍催化条件下起反应,则为烯、炔、苯及其同系物、醛的加成反应(或还原反应)。
⑤能在稀硫酸作用下发生反应,则为酯、二糖、淀粉等的水解反应。
⑥能与溴水反应,可能为烯烃、炔烃的加成反应。
根据反应类型推断官能团: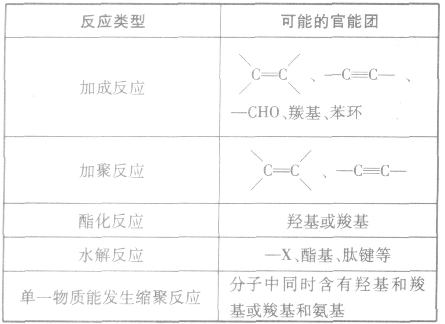
利用官能团的衍生关系进行衍变(从特定的转化关系上突破):
(1)
(2)芳香化合物之间的相互转化关系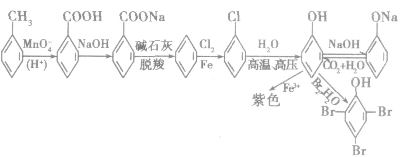
与“某芳香烃X是一种重要的有机化工原料,它的相对分子质量为92。...”考查相似的试题有:
- 在化学上经常使用氢核磁共振谱,根据不同化学环境的氢原子在氢核磁共振谱中给出的信号不同,来确定有机物分子中的不同的氢原...
- 一种烃的含氧衍生物C是生活中的食用香料(G相对分子质量为l92),可以通过下列途径合成:已知:回答下列问题:(1)将1.92g G...
- 下列物质中能使酸性高锰酸钾溶液褪色的是A.乙烷B.乙烯C.乙醇D.乙酸
- 不饱和脂肪酸是常见的保健品,DHA(分子式为C22H32O2)是近年来倍受关注的一元不饱和高级脂肪酸(分子中只含有双键),它对大脑...
- 下列物质一定属于同系物的是A.①和②B.④和⑥C.⑤和⑦D.③和④
- 氨分子中氢原子被氨基(-NH2)取代后的生成物叫肼(),肼分子中氢原子被烃基取代后的产物叫肼的衍生物,分子式为C2H8N2的同分...
- 分子式为C7H16,含有三个甲基的同分异构体的数目是[ ]A.2种B.3种C.4种D.5种
- (12分)二乙酸—1,4—环己二醇酯可通过下列路线合成:(1)上述合成过程中没有涉及的反应类型是 ▲ A.加成B.消去C.取代D....
- I 已知:烃基烯基醚A的相对分子质量(Mr)为176,分子中碳氢原子数目比为3:4。与A相关的反应如下:请回答下列问题:(1)A的分...
- MMA既是一种高分子化合物(有机玻璃)的单体,又是制取甲基丙烯酸丙酯等的重要原料。现有三条制备高分子(MMA)的途径,其流...