本试题 “试回答下列问题(温度均为25℃时):(1)将0.2mol/L HB溶液与0.1mol /L MOH溶液等体积混合,测得混合溶液的pH=4,则混合溶液中由水电离出的c(H+)_________0...” 主要考查您对水的电离平衡
溶液的酸碱性
电解池电极反应式的书写
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 水的电离平衡
- 溶液的酸碱性
- 电解池电极反应式的书写
水的电离:
水是一种极弱的电解质,可以发生微弱电离,电离方程式为:H2O H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L
H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L
注:水的电离是永恒存在的,不研究水溶液的体系中均存在水的电离平衡,不要忽略H+和OH-共同存在。
水是一种极弱的电解质,可以发生微弱电离,电离方程式为:H2O
 H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L
H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L 注:水的电离是永恒存在的,不研究水溶液的体系中均存在水的电离平衡,不要忽略H+和OH-共同存在。
溶液的酸碱性:
(1)pH=-lg[c(H+)],在溶液的c(H+)很小时,用pH来表示溶液的酸度。
(2)pH越大,c(H+)越小,c(OH-)越大,酸性越弱,碱性越强。pH越小,c(H+)越大,c(OH-)越小,酸性越强,碱性越弱。
(3)pH的范围:0~14
(4)溶液酸碱性判断:
当c(H+)>c(OH-)时,溶液呈酸性;
当c(H+)>=c(OH-)时,溶液呈键性;
当c(H+)<c(OH-)时,溶液呈中性。
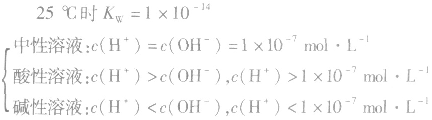
(5)关于pH相同的酸(含强酸和弱酸)
①溶液中c(H+)相等(填“相等”或“不等”)。
②溶液中溶质的物质的量的浓度:强酸<弱酸(填“>”或“<”)。
③耗碱规律:pH和溶液体积均相同的HCl、H2SO4、CH3COOH与碱完全反应时,消耗碱物质的量最多的是CH3COOH。
④稀释规律:分别加水稀释m倍时,溶液的物质的量的浓度均变为原来的1/m,强酸中c(H+)变为原来的1/m,但弱酸中c(H+)减小小于(填“大于”或“小于”)m倍,故稀释后弱酸酸性强于强酸。
(1)pH=-lg[c(H+)],在溶液的c(H+)很小时,用pH来表示溶液的酸度。
(2)pH越大,c(H+)越小,c(OH-)越大,酸性越弱,碱性越强。pH越小,c(H+)越大,c(OH-)越小,酸性越强,碱性越弱。
(3)pH的范围:0~14
(4)溶液酸碱性判断:
当c(H+)>c(OH-)时,溶液呈酸性;
当c(H+)>=c(OH-)时,溶液呈键性;
当c(H+)<c(OH-)时,溶液呈中性。
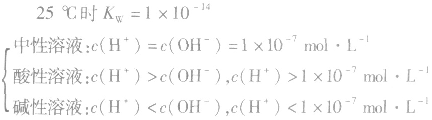
(5)关于pH相同的酸(含强酸和弱酸)
①溶液中c(H+)相等(填“相等”或“不等”)。
②溶液中溶质的物质的量的浓度:强酸<弱酸(填“>”或“<”)。
③耗碱规律:pH和溶液体积均相同的HCl、H2SO4、CH3COOH与碱完全反应时,消耗碱物质的量最多的是CH3COOH。
④稀释规律:分别加水稀释m倍时,溶液的物质的量的浓度均变为原来的1/m,强酸中c(H+)变为原来的1/m,但弱酸中c(H+)减小小于(填“大于”或“小于”)m倍,故稀释后弱酸酸性强于强酸。
溶液的pH:
1.定义:溶液里H+的物质的量浓度的负对数叫做pH。
2.表达式:
3.含义: pH越大,c(H+)越小,c(O-一)越大,酸性越弱,碱性越强。pH越小,c(H+)越大,c(OH-)越小,酸性越强,碱性越弱。
4.适用范围:
c(H+)很小时,用pH来表示溶液的酸碱度更方便。所以,pH适用于酸、碱的稀溶液
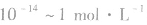 之间],pH取值范刚为0~14。
之间],pH取值范刚为0~14。
5.溶液的酸碱性和pH: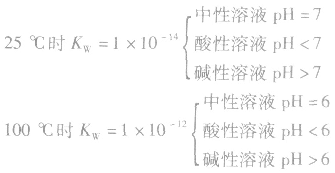
电极反应式的书写:
1.根据装置书写电极反应式
(1)根据电源确定阴、阳两极→确定阳极是否是活性电极→据电极类型及电解质溶液中阴、阳离子的放电顺序写出电极反应式。
(2)在确保阴、阳两极转移电子数目相同的条件下,将两极电极反应式合并即得总反应式。
2.由氧化还原反应方程式书写电极反应式
(1)找出发生氧化反应和还原反应的物质→确定两极名称和生成物→利用电子守恒分别写出两极反应式。
(2)若写出一极反应式,而另一极反应式不好写,可用总反应式减去已写出的电极反应式,即得另一电极反应式。
1.根据装置书写电极反应式
(1)根据电源确定阴、阳两极→确定阳极是否是活性电极→据电极类型及电解质溶液中阴、阳离子的放电顺序写出电极反应式。
(2)在确保阴、阳两极转移电子数目相同的条件下,将两极电极反应式合并即得总反应式。
2.由氧化还原反应方程式书写电极反应式
(1)找出发生氧化反应和还原反应的物质→确定两极名称和生成物→利用电子守恒分别写出两极反应式。
(2)若写出一极反应式,而另一极反应式不好写,可用总反应式减去已写出的电极反应式,即得另一电极反应式。
发现相似题
与“试回答下列问题(温度均为25℃时):(1)将0.2mol/L HB溶液与0...”考查相似的试题有:
- 已知两种弱酸HA、HB的电离平衡常数Ka(HA)>Ka(HB)。下列有关说法正确的是A.等温浓度均为0.1 mol·L-1的HA、HB溶液中,其...
- 有人曾建议用AG表示溶液的酸度(acidity grade),AG的定义为AG=lg(c(H+)/c(OH-))。请回答下列问题:(1)在25℃时,...
- 室温时下列混合溶液的pH一定小于7的是A.pH=3的盐酸和pH=11的氨水等体积混合B.pH=3的盐酸和pH=11的氢氧化钡等体积混合C.p...
- 下列各溶液中,微粒的物质的量浓度关系正确的是A.等体积、等物质的量浓度的CH3COONa与CH3COOH溶液混合:2c(Na+)=c(CH3C...
- 实验室有一瓶混有氯化钠的氢氧化钠固体试剂,经测定氢氧化钠的质量分数约为82%,为了验证其纯度,用浓度为0.2 mol·L-1的盐酸...
- 室温下,向0.1 mol·L-1的硫酸溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如...
- 由一价离子组成的四种盐溶液:AC、BD、AD、BC,浓度均为O.1 mol·L-1。在室温下,前两种溶液的pH=7,第三种溶液的pH>7,最后一...
- 以A、B两根石墨棒作电极,电解AgNO3溶液,通电t min,在B极收集到气体11.2 mL(标准状况),然后将电源反接,以相同的电流通...
- 请从下图中选出必要的装置进行电解饱和食盐水的实验,要求测定产生的H2的体积( 大于25 mL) ,并检验Cl2的氧化性。(1 )A 极...
- 随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%。目前,消除大气...