本试题 “工业上对海水资源综合开发利用的部分工艺流程如图1所示.(1)粗盐中含有Ca2+、Mg2+、SO42-等杂质,粗制后可得饱和NaCl溶液,精制时通常在溶液中依次中加入过...” 主要考查您对粗盐的提纯
海水资源的综合利用
工业生产纯碱
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 粗盐的提纯
- 海水资源的综合利用
- 工业生产纯碱
粗盐的提纯:
(1)实验仪器和药品
药品:粗盐,水
器材:托盘天平,量筒,烧杯,玻璃棒,药匙,漏斗,铁架台(带铁圈),蒸发皿,酒精灯,坩埚钳,胶头滴管,滤纸,剪刀,火柴,纸片
(2)实验原理:粗盐中含有泥沙等不溶性杂质,以及可溶性杂质如:Ca2+、Mg2+等不溶性杂质可以用溶解、过滤的方法除去,然后蒸发水分得到较纯净的精盐
(3)实验操作
①溶解:用托盘天平称取5克粗盐(精确到0.1克)。用量筒量取10毫升水倒入烧杯里.用药匙取一匙粗盐加入水中,观察发生的现象。用玻璃棒搅拌,并观察发生的现象(玻璃棒的搅拌对粗盐的溶解起什么作用?)。接着再加入粗盐,边加边用玻璃棒搅拌,一直加到粗盐不再溶解时为止。观察溶液是否浑浊。
在天平上称量剩下的粗盐,计算在10毫升水中大约溶解了多少克粗盐.
②过滤:按照过滤的操作进行过滤,仔细观察滤纸上的剩余物及滤液的颜色。滤液仍浑浊时,应该再过滤一次。如果经两次过滤滤液仍浑浊,则应检查实验装置并分析原因,例如:滤纸破损,过滤时漏斗里的液面高于滤纸边缘,仪器不干净等,找出原因后,要重新操作。
③蒸发:把得到的澄清滤液倒入蒸发皿,把蒸发皿放在铁架台的铁圈上,用酒精灯加热,同时用玻璃棒不断搅拌滤液。等到蒸发皿中出现较多量固体时,停止加热。利用蒸发皿的余热使滤液蒸干。
④用玻璃棒把固体转移到纸上,称量后,回收到教师指定的容器,比较提纯前后食盐的状态并计算精盐的产率。
(1)实验仪器和药品
药品:粗盐,水
器材:托盘天平,量筒,烧杯,玻璃棒,药匙,漏斗,铁架台(带铁圈),蒸发皿,酒精灯,坩埚钳,胶头滴管,滤纸,剪刀,火柴,纸片
(2)实验原理:粗盐中含有泥沙等不溶性杂质,以及可溶性杂质如:Ca2+、Mg2+等不溶性杂质可以用溶解、过滤的方法除去,然后蒸发水分得到较纯净的精盐
(3)实验操作
①溶解:用托盘天平称取5克粗盐(精确到0.1克)。用量筒量取10毫升水倒入烧杯里.用药匙取一匙粗盐加入水中,观察发生的现象。用玻璃棒搅拌,并观察发生的现象(玻璃棒的搅拌对粗盐的溶解起什么作用?)。接着再加入粗盐,边加边用玻璃棒搅拌,一直加到粗盐不再溶解时为止。观察溶液是否浑浊。
在天平上称量剩下的粗盐,计算在10毫升水中大约溶解了多少克粗盐.
②过滤:按照过滤的操作进行过滤,仔细观察滤纸上的剩余物及滤液的颜色。滤液仍浑浊时,应该再过滤一次。如果经两次过滤滤液仍浑浊,则应检查实验装置并分析原因,例如:滤纸破损,过滤时漏斗里的液面高于滤纸边缘,仪器不干净等,找出原因后,要重新操作。
③蒸发:把得到的澄清滤液倒入蒸发皿,把蒸发皿放在铁架台的铁圈上,用酒精灯加热,同时用玻璃棒不断搅拌滤液。等到蒸发皿中出现较多量固体时,停止加热。利用蒸发皿的余热使滤液蒸干。
④用玻璃棒把固体转移到纸上,称量后,回收到教师指定的容器,比较提纯前后食盐的状态并计算精盐的产率。
海水资源的综合利用:
浩瀚的海洋是个巨大的资源宝库,它不仅孕育着无数的生命,还孕育着丰富的矿产,而海水本身含有大量的化学物质,又是宝贵的化学资源。可从海水中提取大量的食盐、镁、溴、碘、钾等有用物质,海水素有“液体工业原料”之美誉。
浩瀚的海洋是个巨大的资源宝库,它不仅孕育着无数的生命,还孕育着丰富的矿产,而海水本身含有大量的化学物质,又是宝贵的化学资源。可从海水中提取大量的食盐、镁、溴、碘、钾等有用物质,海水素有“液体工业原料”之美誉。
海水制盐:
(1)海水制盐的方法:从海水中得到食盐的方法有蒸发法(盐田法)、电渗析法等。目前,以蒸发法(盐田法)为主。
(2)海水晒盐的基本原理:水分不断蒸发,氯化钠等盐结晶析出。
(3)海水晒盐的流程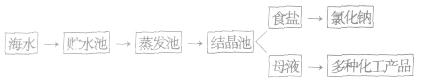
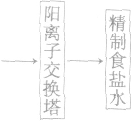
氯碱工业:
(1)食盐水的精制
(2)电极反应
阴极: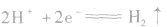
阳极:
总反应: :
:
(3)主要设备
离子交换膜电解槽一一阳极用金属钛(表面涂有钛、钉氧化物层)制成,阴极用碳钢(覆有镍镀层)制成。阳离子膜具有选择透过性,只允许Na+透过,而Cl-、 OH一和气体不能透过。 
(4)产品及用途
烧碱:可用于造纸、玻璃、肥皂等工业
氯气:可用于制农药、有机合成、氯化物的合成
氢气:可用于金属冶炼、有机合成、盐酸的制取
海水提溴:
(1)氯化
氯化氧化溴离子,在pH=3.5的酸性条件下效果最好,所以在氯化之前要将海水酸化。
(2)吹出
当海水中的Br一被氧化成Br2以后,用空气将其吹出。另外,也可以用水蒸气,使溴和水蒸气一起蒸出。
(3)吸收
目前比较多的是用二氧化硫作还原剂,使溴单质转化为HBr,再用氯气将其氧化得到溴产品。化学方程式如下: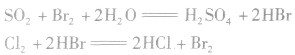
海水提镁:
(1)工艺流程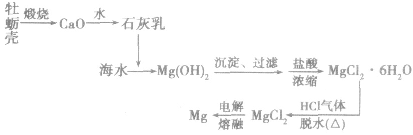
(2)主要化学反应
①制备石灰乳: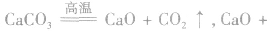
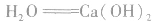
②沉淀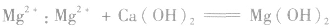
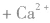
③制备
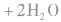
从海水中提取重水:
提取重水的方法:蒸馏法、电解法、化学交换法、吸附法等。常用方法:化学交换法(硫化氢一水双温交换法)
铀和重水目前是核能开发中的重要原料,从海水中提取铀和重水对一个国家来说具有战略意义,化学在开发海洋药物方面也将发挥越来越大的作用。潮汐能、波浪能也是越来越受到重视的新型能源。
工业生产纯碱:
纯碱(学名碳酸钠)实际上是盐,由于它在水中发生水解作用而使溶液呈碱性。纯碱易溶于水,呈强碱性,能提供
Na+离子。这些性质使它们被广泛地用于制玻璃、肥皂、纺织、印染、漂白、造纸、精制石油、冶金及其他化学工业等各部门中。
碳酸钠在自然界中存在相当广泛。一些生长在盐碱地和海岸附近的植物中含有碳酸钠,可以从植物的灰烬中提取;当冬季来临时,碱湖中所含的碳酸钠结晶析出,经过简单的加工就可以使用。
世界上最早是通过路布兰法实现了碳酸钠的工业生产。其生产原理是:
用硫酸将食盐转变成硫酸钠
NaCl+H2SO4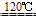 NaHSO4+HCl↑NaCl+NaHSO4
NaHSO4+HCl↑NaCl+NaHSO4 Na2SO4+HCl↑
Na2SO4+HCl↑
将硫酸钠与木炭、石灰石一起加热,反应生成碳酸钠和硫化钙
Na2SO4+2C Na2S+2CO2↑ Na2S+CaCO3
Na2S+2CO2↑ Na2S+CaCO3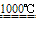 Na2CO3+CaS
Na2CO3+CaS
存在原料利用不充分、成本较高、设备腐蚀严重等
氨碱法生产硫酸:
氨碱法是由比利时人索尔维发明的,所以,氨碱法也称为索尔维制碱法。氨碱法的原料也是氯化钠和碳酸钙,不同的是它还使用了炼焦的副产品氨。
原料:CaCO3、NaCl、NH3
1.生成碳酸氢钠和氯气铵
将CO2通入含NH3的饱和NaCl溶液中
NH3+CO2+H2O==NH4HCO3 NaCl+NH4HCO3==NaHCO3↓+NH4Cl
2.抽取碳酸钠2NaHCO3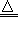 Na2CO3+CO2↑+H2O↑
Na2CO3+CO2↑+H2O↑
氨碱法生产原理:
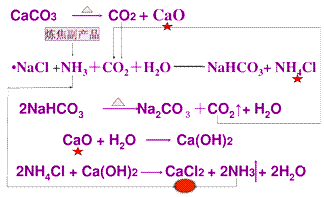
氨碱法的优点:原料便宜易得,氨和部分二氧化碳可循环利用,产品纯度高,步骤简单。氨碱法的缺点:副产物氯化钙的处理问题,氯化钠的利用率低。
联合制碱法:
我国化学侯德榜(下图)改革国外的纯碱生产工艺,生产流程可简要表示如下:

(1)上述生产纯碱的方法称联合制碱法或侯德榜制碱法,副产品的一种用途为化肥或电解液或焊药等。
(2)沉淀池中发生的化学反应方程式是NH3+CO2+H2O+NaCl=NH4Cl+NaHCO3↓或NH3+CO2+H2O=NH4HCO3 NH4HCO3+NaCl=NaHCO3↓+NH4Cl。
(3)写出上述流程中X物质的分子式CO2。
(4)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了I 的循环。从沉淀池中取出沉淀的操作是过滤
(5)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加稀硝酸和硝酸银溶液
(6)向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用是:
①增大NH4+的浓度,使NH4Cl更多地析出②使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
联合法综合利用了合成氨的原料,提高了氯化钠的利用率,减少了环境污染。
NH3、CO2都来自于合成氨工艺;这样NH4Cl就成为另一产品化肥。综合利用原料、降低成本、减少环境污染,NaCl利用率达96%。
纯碱(学名碳酸钠)实际上是盐,由于它在水中发生水解作用而使溶液呈碱性。纯碱易溶于水,呈强碱性,能提供
Na+离子。这些性质使它们被广泛地用于制玻璃、肥皂、纺织、印染、漂白、造纸、精制石油、冶金及其他化学工业等各部门中。
碳酸钠在自然界中存在相当广泛。一些生长在盐碱地和海岸附近的植物中含有碳酸钠,可以从植物的灰烬中提取;当冬季来临时,碱湖中所含的碳酸钠结晶析出,经过简单的加工就可以使用。
世界上最早是通过路布兰法实现了碳酸钠的工业生产。其生产原理是:
用硫酸将食盐转变成硫酸钠
NaCl+H2SO4
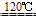 NaHSO4+HCl↑NaCl+NaHSO4
NaHSO4+HCl↑NaCl+NaHSO4 Na2SO4+HCl↑
Na2SO4+HCl↑ 将硫酸钠与木炭、石灰石一起加热,反应生成碳酸钠和硫化钙
Na2SO4+2C
 Na2S+2CO2↑ Na2S+CaCO3
Na2S+2CO2↑ Na2S+CaCO3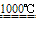 Na2CO3+CaS
Na2CO3+CaS 存在原料利用不充分、成本较高、设备腐蚀严重等
氨碱法生产硫酸:
氨碱法是由比利时人索尔维发明的,所以,氨碱法也称为索尔维制碱法。氨碱法的原料也是氯化钠和碳酸钙,不同的是它还使用了炼焦的副产品氨。
原料:CaCO3、NaCl、NH3
1.生成碳酸氢钠和氯气铵
将CO2通入含NH3的饱和NaCl溶液中
NH3+CO2+H2O==NH4HCO3 NaCl+NH4HCO3==NaHCO3↓+NH4Cl
2.抽取碳酸钠2NaHCO3
 Na2CO3+CO2↑+H2O↑
Na2CO3+CO2↑+H2O↑ 氨碱法生产原理:

氨碱法的优点:原料便宜易得,氨和部分二氧化碳可循环利用,产品纯度高,步骤简单。氨碱法的缺点:副产物氯化钙的处理问题,氯化钠的利用率低。
联合制碱法:
我国化学侯德榜(下图)改革国外的纯碱生产工艺,生产流程可简要表示如下:

(1)上述生产纯碱的方法称联合制碱法或侯德榜制碱法,副产品的一种用途为化肥或电解液或焊药等。
(2)沉淀池中发生的化学反应方程式是NH3+CO2+H2O+NaCl=NH4Cl+NaHCO3↓或NH3+CO2+H2O=NH4HCO3 NH4HCO3+NaCl=NaHCO3↓+NH4Cl。
(3)写出上述流程中X物质的分子式CO2。
(4)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了I 的循环。从沉淀池中取出沉淀的操作是过滤
(5)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加稀硝酸和硝酸银溶液
(6)向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用是:
①增大NH4+的浓度,使NH4Cl更多地析出②使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
联合法综合利用了合成氨的原料,提高了氯化钠的利用率,减少了环境污染。
NH3、CO2都来自于合成氨工艺;这样NH4Cl就成为另一产品化肥。综合利用原料、降低成本、减少环境污染,NaCl利用率达96%。
发现相似题
与“工业上对海水资源综合开发利用的部分工艺流程如图1所示.(1...”考查相似的试题有:
- (8分)设计一个实验证明明矾晶体KAl(SO4)2·12H2O中含有K+、Al3+、和H2O。
- (12分)现有一包AlCl3和FeCl3的混合粉末,欲将其中的Al元素和Fe元素分开,可进行如下操作:(1) 操作①名称是 ,操作②名称是 (...
- 实验室进行过滤和蒸发操作时,都要用到的仪器是A.烧杯B.玻璃棒C.蒸发皿D.酒精灯
- (10分)江苏省拥有很长的海岸线,具有丰富的海洋资源,因此盐化工是本省的一个重要产业。从盐卤初步得到的光卤石(KCl·MgCl2·6H...
- 下列各组物质,用一种试剂无法区别的是 A.FeC12、AgNO3、Na2CO3、Na2SO3B.NaNO3、A1C13、NaCl、MgC12C.苯、己烯、四氯化碳...
- 为提纯下列物质(括号内物质为杂质),所选用的试剂和分离方法正确的是 物 质除杂试剂分离方法A硝酸铜溶液(硝酸银)铜粉结晶...
- 下列各组混合物,可以用分液漏斗分离的是A.甲苯和水B.甲苯和苯C.溴乙烷与水D.苯与溴乙烷
- 观察能力是学习化学的一种非常重要的能力。请仔细观察下列各图,正确的是:A.装置①常用于分离互相溶解但沸点不同的液体混合...
- (8分)有A、B、C、D四种无色溶液,它们分别是葡萄糖溶液、蔗糖溶液、淀粉溶液、甲酸乙酯中的一种,经实验可知:① B、C均能发...
- “天蓝蓝海蓝蓝,海边小城威海卫”.威海海水资源丰富,回答下列问题:(1)海水中主要含有______等离子(写离子符号,至少答出...