本试题 “甲醛是居室污染的主要成分之一.根据它的化学式 CH2O,可以做出4点推断其中错误的是( )A.醛是有三种元素组成的B.甲醛的相对分子质量为30C.甲醛中C、H、O...” 主要考查您对构成物质的微粒(分子、原子、离子)
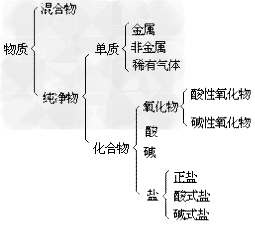
纯净物和混合物
化学式的写法和意义
物质组成元素的质量比
元素的定义
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 构成物质的微粒(分子、原子、离子)
- 纯净物和混合物
- 化学式的写法和意义
- 物质组成元素的质量比
- 元素的定义
分子、原子、离子是构成物质的基本微粒。
分子,原子,离子的比较:
| 分子 | 原子 | 离子 | |
| 概念 | 保持物质化学性质的最小粒子 | 是化学变化中的最小粒子 | 带电的原子或原子团 |
| 表示方法 | 用化学式表示. 如H2,He | 用元素符号表示,如H,Fe | 用离子符号表示,如Na+、NO3- |
| 微粒的运动 | 物理变化是分子运动的结果,如:水的蒸发 | 化学变化是原子运动的结果. 如:水的电解 | 离子运动的结果可能是物理变化。也可能是化学变化,如:NaCl的溶解是物理变化, NaCl与AgNO3反应是化学变化 |
| 化学计量数与符号的关系 | 化学式、元素符号、离子符号前加上化学计量数,如2H,2H2,3Na+,只表示原子、分子、离了的“个数”,不表示元素和物质 | ||
| 联系 |  | ||
分子和原子的比较:
| 原子 | 分子 | |
| 定义 | 化学变化中的最小粒子 | 保持物质(由分子直接构成的物质)化学性质的最小粒子 |
| 相同点 | ①都是构成物质的基本粒子,有些物质是由分子构成的.有些物质是由原子直接构成的; ②都很小,但者阶一定的体积和质量; ③都在不断地运动; ④微粒子间都有间隔; ⑤都能保持物质的化学性质 | |
| 区别 | 化学变化中不能再分 | 化学变化中可以再分 |
| 如:在电解水实验中,水分子可以分成氢原子和氧原子,而氢原子和氧原子不可以再分,只是重新组合成氢分子、氧分子 | ||
| 同种原子具有相同的质子数 | 同种分子化学性质相同 | |
| 联系 | 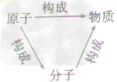 | |
原子与离子的比较:
| 原子 | 离子 | |
| 概念 | 化学变化中最小粒子 | 带电荷的原子或原子团 |
| 电性 | 呈电中性,不带电 | 带电: 阳离子带正电 阴离子带负电 |
| 表示方法 | 用元素符号表示;Na 表示钠原子,2Na表示2个钠原子 | 在元素符号右上角先写电荷数,后标出电性 (+、-):Na+表示钠离子,2Na+表示2个钠离子 |
| 数量关系 | 核内质子数=核外电子数 | 阳离子:核内质子数> 核外电子数 阴离子:核内质子数< 核外电子数 |
| 相似点 | 都是构成物质的一种粒子 | |
| 转化 |  | |
混合物:
(1)概念:由两种或多种物质混合而成的物质,没有有固定的组成,各成分保持自己原有的化学性质。
(3)常见的混合物:空气、合金、矿石、溶液等。
(4)混合物的提纯:混合物经过物理或化学的方法可以提纯。
纯净物:
(1)概念:只由一种物质组成的物质。
(3)纯净物的分类:纯净物根据物质组成的元素种类,分为两大类:单质和化合物。
纯净物和氧化物的区别:
| 纯净物 | 混合物 | |
| 概念 | 宏观:由一种物质组成的物质 微观:由同种分子构成(对于由分子构成的物质而言) |
宏观:由两种或多种物质组成的物质 微观:由不同种分子构成(对于由分子构成的物质而言) |
| 区别 | 由同种物质组成(对于由分子构成的物质,是由同种分子构成的),组成是固定的 | 由不同种物质组成(对于由分子构成的物质. 是由不同种分子构成的),组成是不固定的 |
| 特点 | ①具有固定的组成 ②具有一定的性质 ③有专门的化学符号 |
①没有固定的组成和性质 ②各成分保持各自的性质 ③没有专门的化学符号 |
| 分离方法 | 组成固定,不需分离;若需将化合物分成几种单质,则必须通过化学方法才能实现 | 物理方法: 筛选 过滤 蒸馏 |
| 实例 | 氧气,二氧化碳,高锰酸钾 | 空气,粗盐,蔗糖水 |
| 联系 | 纯净物是相对而言的,自然界中绝对纯净的物质是不存在的,通常的纯净物是指含杂质很少的具有高纯度的物质。两者间的关系为 | |
对纯净物和混合物概念的理解:
(1)混合物概念:混合物可以看作是由几种纯净物混合而成的,混合物的形成过程中发生的是物理变化。由于混合物的组成一般不固定,所以往往不能用化学式表示。
(2)纯净物概念:纯净物只由一种物质组成,有固定的组成.可以用化学式表示。
常考的纯净物与混合物:
(1)混合物:石油、煤、天然气、洁净的空气、生理盐水、矿泉水、汽水、碘酒、白酒、双氧水、盐酸、合金等都是混合物。
(2)纯净物:水银、烧碱、纯碱、胆矾、液态氧、液态氮、蒸馏水(纯水)、干冰、冰水共存物、金刚石、石墨、生石灰、熟石灰、氯化钠、氧化铁等都是纯净物:
物质的分类示意图:
用元素符号和数字的组合表示物质组成的式子,叫做化学式。如可用O2,H2O,MgO分别表示氧气、水、氧化镁的化学式。
对概念的理解:
(1)混合物不能用化学式表示,只有纯净物才能用化学式表示。
(2)每一种纯净物只有一个化学式,但一个化学式有可能用来表示不同的物质。如氧气的化学式是O2,没有别的式子再能表示氧气;P既是红磷的化学式,也是白磷的化学式。
(3)纯净物的化学式不能臆造,化学式可通过以下途径确定:
①科学家通过进行精确的定量实验,测定纯净物中各元素的质量比,再经计算得出。
②已经确定存在的物质可根据化合价写出。
书写规则:
1.单质化学式的写法:
首先写出组成单质的元素符号,再在元素符号右下角用数字写出构成一个单质分子的原子个数。稀有气体是由原子直接构成的,通常就用元素符号来表示它们的化学式。金属单质和固态非金属单质的结构比较复杂,习惯上也用元素符号来表示它们的化学式。
2.化合物化学式的写法:
首先按正前负后的顺序写出组成化合物的所有元素符号,然后在每种元素符号的右下角用数字写出每个化合物分子中该元素的原子个数。一定顺序通常是指:氧元素与另一元素组成的化合物,一般要把氧元素符号写在右边;氢元素与另一元素组成的化合物,一般要把氢元素符号写在左边;金属元素、氢元素与非金属元素组成的化合物,一般要把非金属元素符号写在右边。直接由离子构成的化合物,其化学式常用其离子最简单整数比表示。
化学式的读法:
一般是从右向左叫做“某化某”,如“CuO”叫氧化铜。当一个分子中原子个数不止一个时,还要指出一个分子里元素的原子个数,如“P2O5”叫五氧化二磷。有带酸的原子团要读成“某酸某”如“CuSO4”叫硫酸铜,还有的要读“氢氧化某”,如“NaOH”叫氢氧化钠。“氢氧化某”是碱类物质,电离出来的负电荷只有氢氧根离子。
化学式的意义:
(1)由分子构成的物质
| 化学式的含义 | 以H2O为例 | ||
| 质的含义 | 宏观 | ①表示一种物质 ②表示物质的元素组成 |
①表示水 ②表示水是由氢、氧两种元素组成的 |
| 微观 | ①表示物质的一个分子 ②表示组成物质每个分子的原子种类和数目 ③表示物质的一个分子中的原子总数 |
①表示一个水分子 ②表示一个水分子是由两个氧原子和一个氧原子构成的 ③表示一个水分子中含有三个原子 | |
| 量的含义 | ①表示物质的相对分子质量 ②表示组成物质的各元素的质量比 ③表示物质中各元素的质量分数 |
①H2O的相对分子质R =18 ②H2O中氢元素和氧元素质量比为1:8 ③H2O中氢元素的质量分数= 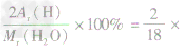 100%=11.1% 100%=11.1% | |
(2)由原子构成的物质(以Cu为例)
宏观:
表示该物质:铜
表示该物质由什么元素组成:铜由铜元素组成
微观:表示该物质的一个原子—一个铜原子。
化学式和化合价的关系:
(1)根据化学式求化合价
①已知物质的化学式,根据化合价中各元素的正负化合价代数和为0的原则确定元素的化合价。
标出已知、未知化合价: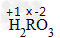
列出式子求解:(+1)×2+x×1+(-2)×3=0 x=+4
②根据化合价原则,判断化学式的正误,如判断化学式KCO3是否正确
标出元素或原子团的化合价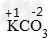
计算正负化合价代数和是否为0:(+1)×1+(-2)×1=-1≠0,所以给出的化学式是错误的,正确的为K2CO3。
③根据化合价原则,计算原子团中某元素的化合价,如计算NH4+中氮元素的化合价和H2PO4-(磷酸二氢根)中磷元素的化合价。
由于NH4+带一个单位的正电荷,不是电中性的,因此各元素的化合价代数和不为多,而是等于+1. 设氮元素的化合价为x
x+(+1)×4=+1 x=-3
所以在NH4+中,氮元素的化合价为-3. 同理H2PO4-带一个单位的负电荷、不是电中性的、因此各元素的化合价代数和不为零,而是-1.
设磷元素的化合价为y
(+1)×2+y+(-2)×4=-1 y=+5 所以在H2PO4-中磷元素的化合价为+5.
④根据化合价原则,确定物质按化合价的排序。如H2S,S,SO2,H2SO4四种物质中均含有硫元素,并且硫元素的化合价在四种物质中分别为:-2,0, +4,+6,故这四种物质是按硫元素的化合价由低到高的顺序排列的。
(2)根据化合价写化学式
根据化合物中化合价的代数和等于0的原则,已知元素的化合价可以推求实际存在物质的化学式,主要方法有两种:
①最小公倍数法
| 步骤 | 举例 | |
| 写 | 一般把正价元素的符号(或原子团)写在左边,负价元素的符号(或原子团)写在右边,并把化合价写在元素符号(或原子团)的正上方 | 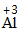 、 、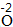 |
| 求 | 求出两种元素化合价绝对位的最小公倍数,然后求出每种元素的原子个数= |
因为|-2|×|+3|=6,所以Al原子个数为6/3=2,O原子个数=6/2=3 |
| 标 | 将原子个数写在相应元素符号的正下角 | Al2O3 |
| 验 | 检验各种元素正负化合价的代数和是否为0,确定化学式的正确性 | (+3)×2+(-2)×3=0,所以该化学式正确。 |
| 步骤 | 例1 硫酸铜 | 例2 氧化钙 | |
| 排列 | 分析名称,确定元素符号(或原子团)的顺序 | 铝 硫酸根 Al SO4 |
钙 氧 Ca O |
| 标价 | 标上化合价 | 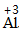 、 、 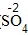 |
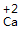 、 、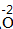 |
| 约简 | 将化合价的绝对值约成最简整数比 |  、 、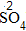 |
 、 、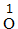 |
| 交叉 | 将整数交叉写在元素符号(或原子团)的右下角 |  |
 |
| 检验 | 根据正负化合价代数和是否为0,检验正误 | (+3)×2+(-2)×3=0 | (+2)+(-2)=0 |
确定化学式的几种方法:
1. 根据化合价规则确定化学式
例1:若A元素的化合价为+m,B元素的化合价为-n,已知m与n都为质数,求A,B两元素化合后的物质的化学式。
解析:由题意知正、负化合价的最小公倍数为m ·n,A的原子个数为(m·n)/m=n,B的原子个数为 (m·n)/n=m
答案:所求化学式为AnBm.
2. 根据质量守恒定律确定化学式
例2:根据反应方程式2XY+Y2==2Z,确定Z 的化学式
解析:根据质量守恒定律,反应前后原子种类不变,原子数目没有增减,反应前有两个X原子,四个Y原子,则两个Z分子含有两个X原子和四个Y原子。
答案:z的化学式为XY2
3. 利用原子结构特征确定化学式
例3:X元素的原子核外有17个电子,Y元素的原子最外层有2个电子,求X、Y两元素所形成的化合物的化学式。
解析:X元素的原子核外有17个电子,Y元素的原子最外层有2个电子,X原子易得1个电子,Y原子易失2个电子,根据电子得失相等可求化合物的化学式为YX2
4.利用元素质量比确定化学式:
例4:有一氮的氧化物,氮、氧两元素的质量比为7: 4,求此氧化物的化学式。
解析:设此氧化物的化学式为NxOy,根据xN:yO =7:4 得14x:16y=7:4,即x:y=2:1。
答案:所求氧化物的化学式为N2O。
5. 利用化学式中所含原子数、电子数确定化学式
例5:某氮氧化合物分子中含有3个原子,23个电子,求此化合物的化学式。
解析:设此化合物的化学式为NxOy,则
x+y=3
7x+8y=23
解得x=1,y=2
答案:所求化学式NO2。
利用化学式的变形比较元素的原子个数:
例:质量相等的SO2和SO3分子中,所含氧原子的个数比为?
解析:SO2的相对分子质量为64,SO3的相对分子质量为80,二者的最小公倍数是320,二者相对分子质量相等时物质的质量相同,转化为分子个数SO2 为320/64=5,SO3为320/80=4,即5SO2与4SO3质量相同,所以含氧原子的个数比为(5×2):(4×3)=10:12=5:6。
四、利用守恒法进行化学式计算:
例:由Na2S、Na2SO3、Na2SO4三种物质构成的混合物中,硫元素的质量分数为32%,则混合物中氧元素的质量分数为?
解析:在Na2S,Na2SO3,Na2SO4中,钠原子与硫原子的个数比是恒定的,都是2:1,因而混合物中钠、硫元素的质量比(或质量分数比)也是恒定的。设混合物中钠元素的质量分数为x,可建立如下关系式。
Na ——S
46 32
x 32%
46/32=x/32%
解得x=46%
混合物中氧元素的质量分数为1-32%-46%=22%。
利用平均值法判断混合物的组成
找出混合物中各组分的平均值(包括平均相对原子质量、平均相对分子质量、平均质量、平均质量分数等),再根据数学上的平均值原理,此平均值总是介于组成中对应值的最大值与最小值之间,由此对混合物的组分进行推理判断。
例:某气休可能由初中化学中常见的一种或多种气体组成,经测定其中只含C,O两种元素,其质量比为3:8,则该气体可能是?
解析:由题给条件知,该气体只含C,O两种元素,而这两种元素组成的气体可能是CO2、CO,O2。CO2中C,O两种元素的质量比是3:8,CO中C,O两种元素的质量比是3:4,O2中C,O两种元素的质量比是0 (因C的质量为0)。题中给出该气体中C,O两种元素的质量比是3:8,故符合题意的气体组成为:CO2或 CO,O2或CO,O2,CO2。
利用关系式法解题技巧:
关系式法是根据化学式所包含的各种比例关系,找出已知量之间的比例关系,直接列比例式进行计算的方法。
例: 多少克(NH4)2SO4与42.4g尿素CO(NH2)2所含的氮元素质量相等?
设与42.4g尿素中所含氮元素质量相等的(NH4)2SO4的质量为x
(NH4)2SO4——2N——CO(NH2)2
132 60
x 42.4g
132/x=60/42.4g
x=93.28
化学式前和化学式中数字的含义:
①化学式前面的数字表示粒子(原子、分子)数目;
②离子符号前的数字表示离子的数目;
③化学式石一下角的数字表示该粒子中对应原子或原子团的数目;
④离子符号右上角的数字表示该离子所带电荷数。

化合物里各元素的质量比是原子个数与相对原子质量的乘积之比。即各元素原子的相对原子质量总和之比。计算的关键在于正确判断出各元素的原子总数。
公式:
各元素的质量比=各元素相对原子质量与相应原子个数的乘积之比。如化学式为AmBn的物质中,A、B两元素的质量比 =(A的相对原子质量×m):(B的相对原子质量×n)。
对概念公式的理解:
(1)元素是宏观概念,只讲种类,不讲个数。用元素符号表示时,7C素符号前后都不能写数字,如计算四氧化三铁(Fe3O4)中铁元素和氧元素的质量比时不能写成3Fe:4O
(2)在化学式中,原子个数比等于元素的质量除以其相对原子质量之比。如AmBn中A,B两元素的质量比为M:N,则化学式中A,B两元素的原子个数比m:n=

(3)当化学式中含有多种元素时,根据化学式可以计算出全部元素的质量比,也可以计算出其中某几种元素的质量比。
化学式中元素质量比的变式运算:
在AmBn中元素A,B的质量比等于各元素的相对原子质m与原子个数的乘积比,即A,B元素质量比= (A的相对原子质量×m):(B的相对原子质量×n),根据元素质量比的变形运算主要有:
(1)根据某化合物中元素的质最比求化学式根据化合物中元素的质量比(或元素的质量分数比)求化学式,其方法是通过元素的相对原子质量来推断化学式。通过组成元素质量比或元素的质量分数进行分式变换,转换成原子个数(比),推测化学式。
(2)根据某化合物中元素的质量比确定元素的化合价已知某化合物中元素的质量比确定某元素的化合价,可通过元素的质量比及元素的相对原子质量推断化学式中元素的原子个数之比,再根据化合物中正负化合价代数和为零的原则确定元素的化合价。
(3)根据元素的质量比确定元素的相对原子质量
化合物中元素的质量比等于相对原子质量与原子个数的乘积比,利用元素的质量比及化合物中各原子的个数即可求出元素的相对原子质量。相对原子质量之比等于元素的质量除以其原子个数所得的数值之比。
(4)物质的质量比与分子个数比之间的换算:
换算关系:物质的质量比
 分子个数比、如SO3、SO2、O2三种物质的质量比为5:4:2,则SO3、SO2、O2的分子个数比为
分子个数比、如SO3、SO2、O2三种物质的质量比为5:4:2,则SO3、SO2、O2的分子个数比为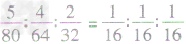 =1:1:1
=1:1:1利用化学式变形求物质的质量比:
例:含有相同质量铁元素的Fe2O3和Fe3O4的质量比是多少?
解析:设含有相同质量铁元素的Fe2O3和Fe3O4的质量分别为x,y,为了使两者含铁元素的质量相等,可以将它们的化学式变形为铁原子数目相等的式子:
Fe2O3→Fe6O9 Fe3O4→Fe6O8
480 464
x y
x:y=480:464=30:29
答案:30:29
对元素概念的理解:
①元素是以核电荷数(即核内质子数)为标准对原子进行分类。只讲种类,不讲个数。
②质子数是划分元素种类的标准。质子数相同的原子和单核离子都属于同一种元素。如Na+与Na都属于钠元素,但Na+与NH4+不属于同一种元素。
③同种元素可以有不同的存在状态。如游离态和化合态。
④同种元素的离子因带电荷数不同,性质也不同。如Fe2+与Fe3+。
⑤同种元素的原子可以是不同种原子。如碳元素有三种不同中子数的碳原子:612C、613C、614C.
元素与原子的比较
| 元素 | 原子 | |
| 概念 | 具有相同核电荷数〔即核内质子数)的一类原子的总称 | 化学变化中的最小粒子 |
| 区分 | 只讲种类,不讲个数 | 既讲种类,又讲个数 |
| 使用范围 | 用于描述物质的宏观组成 | 用于描述物质的微观构成 |
| 举例 | 水由氢元素和氧元素组成,或说水中含有氢元素和氧元素 | 每个水分子由两个氢原子和一个氧原子构成 |
| 联系 | 元素和原子是总体和个体的关系,原子是元素的个体,是构成并体现元素性质的最小微粒;元素是一类原子的总称一种元素可以包含几种原子 | |
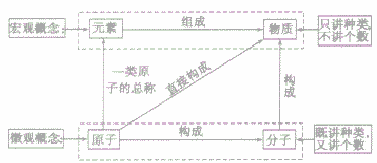
元素、原子、分子与物质间的关系:
物质的组成可以从宏观和微观两个方面进行描述,其中元素是从宏观上对物质组成的描述,分子、原子是从微观上对物质构成的描述。其关系如下图;
在讨论物质的组成和结构时,应注意规范地运用这些概念,现举例如下:
(1)由分子构成的物质,有三种说法(以二氧化碳为例):
①二氧化碳是由氧元素和碳元素组成的。
②二氧化碳是由二氧化碳分子构成的。
③每个二氧化碳分子是由2个氧原子和I个碳原子构成的。
(2)由原子(或离子)直接构成的物质(如汞、食盐),有两种说法:
①汞是由汞元素组成的;食盐是由钠元素和氯元素组成的。
②汞是由汞原子构成的;食盐是由钠离子和氯离子构成的。
同位素:
同位素指具有相同的质子数,但中子数不同的同一元素的不同原子,如氢有3种同位素,分别称为氕(H)、氘(D)、氚T),即原子核内质子数均为1,但中子数分别为0,1,2的氢原子。同位素有天然存在的,也有人工合成的。同一元素的同位素虽然中子数不同,但它们的化学性质基本相同。
与“甲醛是居室污染的主要成分之一.根据它的化学式 CH2O,可以做...”考查相似的试题有:
- 如图是核聚变燃料氦的原子结构模型。该原子核外有2个电子,则其原子核内的质子数为( )A.1B.2C.3D.5
- 据中央电视台6月3日对云南抚仙湖湖底古城考古的现场报道,科学家曾通过测定古生物遗骸的碳14含量来推断古城年代。碳14原子的...
- 物质的分子间有______,气体容易压缩是因为其分子间的______,液体、固体不易压缩是因为它们分子间的______.
- (14分)回答下列问题:(1)构成原子的粒子有 、 和 ;整个原子不显电性的原因是 。(2)构成物质的微观粒子有 、 和 等。例...
- (3分)已知某粒子(原子或离子)的核外共有2个电子层,其结构示意图为:(1)若该粒子为原子时,则m= ;(2)若该粒子为阴离...
- 在我国的化石燃料中______资源较丰富______资源相对不足,它们都属于______(填“纯净物”或“混合物”),它们都主要由______元...
- 兴奋剂检测是体育赛事中的重要环节。其中诺龙(化学式为C18H26O2)就是其中必检的一种兴奋剂,以下关于诺龙的说法正确的是[ ]A...
- 下列物质的化学式书写正确的是( )A.氧化锌OZnB.三氧化硫O3SC.氦气He2D.氧化钙CaO
- 下列各项中知识的归纳错误的一组是[ ]A.环保焚烧法处理废弃塑料生活污水直接排放B.燃料开发“可燃冰”作为未来燃料在农村大力推...
- 化学研究物质的组成和结构,首先假设,然后实验验证,还可以借助仪器验证或者直接观察。如苯组成和结构研究(下图)。苯是由 ...