本试题 “Q、W、X、Y、Z为5种短周期元素,且原子序数依次增大。W、X与Y同周期,Y与Z同主族。Q与W可以按照原子个数比4∶1形成化合物甲,且甲分子中含有10个电子。Q与X形...” 主要考查您对铵盐
极性键、非极性键
共价化合物
电子式的书写
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 铵盐
- 极性键、非极性键
- 共价化合物
- 电子式的书写
定义:
铵盐是由铵根离子(NH4+)和酸根离子组成的化合物。铵盐都是晶体,都易溶于水。
铵盐的物理性质和化学性质:
(1)物理性质:铵盐是由铵离子(NH4+)和酸根阴离子组成的化合物,铵盐都是白色晶体,都易溶于水。
(2)铵盐的化学性质:
①受热分解:固态铵盐受热都易分解,根据组成铵盐的酸根阴离子对应的酸的性质的不同,铵盐分解时有以下三种情况:
A. 组成铵盐的酸根阴离子对应的酸是非氧化性的挥发性酸时,则加热时酸与氨气同时挥发,冷却时又重新化合生成铵盐。例如:
 (试管上端又有白色固体附着)。
(试管上端又有白色固体附着)。又如:
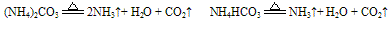
B. 组成铵盐的酸根阴离子对应的酸是难挥发性酸,加热时则只有氨气逸出,酸或酸式盐仍残留在容器中。如:
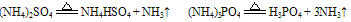
C. 组成铵盐的酸根阴离子对应的酸是氧化性酸,加热时则发生氧化还原反应,无氨气逸出。例如:
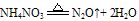
②跟碱反应--铵盐的通性。
固态铵盐+强碱(NaOH、KOH)
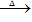 无色、有刺激性气味的气体
无色、有刺激性气味的气体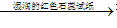 试纸变蓝色。例如:
试纸变蓝色。例如: 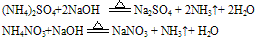
说明:a.若是铵盐溶液与烧碱溶液共热,则可用离子方程式表示为:

b.若反应物为稀溶液且不加热时,则无氨气逸出,用离子方程式表示为:
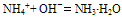
c.若反应物都是固体时,则只能用化学方程式表示。
(3)氮肥的存放和施用.铵盐可用作氮肥.由于铵盐受热易分解,因此在贮存时应密封包装并存放在阴凉通风处;施用氮肥时应埋在土下并及时灌水,以保证肥效。
(1)非极性键:同种元素的原子间形成的共价键(共用电子对不偏移,成键原子双方不显电性)。
如:在非金属单质(H2 Cl2 O2)、共价化合物(H2O2 多碳化合物)、离子化合物(Na2O2 CaC2)中存在。
(2)极性键:不同元素的原子间形成的共价键(共用电子对偏向吸引电子能了强的一方,该元素显负价,偏离吸引电子能力弱的一方,该元素显正价)。如:在共价化合物(HCl H2O CO2 NH3)、某些离子化合物(NaOH Na2SO4 NH4Cl)中存在。
分子空间构型、键的极性与分子的极性:

化学键与物质类别:
1.只含有极性共价键的物质:一般是不同非金属元素构成的共价化合物。例如: 等。
等。
2.只含非极性共价键的物质:同种非金属元素构成的单质。例如: 、金刚石等。
、金刚石等。
3.既有极性键又有非极性键的物质。例如: 等。
等。
4.只含有离子键的物质:活泼非金属元素与活泼金属元素形成的化合物。例如: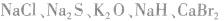 等。
等。
5.既有离子键又有非极性键的物质。例如: 等。
等。
6.既有离子键又有极性键的物质。例如: 等。
等。
7.由离子键、共价键、配位键构成的物质。例如: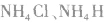 等。
等。
8.只含有共价键而无范德华力的物质。例如:金刚石、晶体硅、 等原子晶体。
等原子晶体。
9.由强极性键构成但又不是强电解质的物质。例如:HF。
10.没有化学键的物质。例如:稀有气体(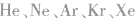 等)。
等)。
直接相邻原子间均以共价键相结合的化合物。共价化合物中只含共价键。
离子化合物和共价化合物的比较:

定义:
在化学反应中,一般是原子的最外层电子数目发生变化。为了简便起见,化学中常在元素符号周围用小黑点“· ”或小叉“×”来表示元素原子的最外层电子,相应的式子叫做电子式。
(1)原子的电子式:H· 、Na· 、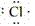
(2)阳离子的电子式:不画出离子最外层电子数,元素右上角标出“n+”电荷字样:Na+、Al3+、Mg2+
(3)阴离子的电子式:要画出最外层电子数,用 “[ ]”括起来,右上角标出“n-”: 、
、 、
、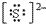
(4)离子化合物的电子式:由阴、阳离子的电子式组成,相同离子不能合并: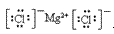 、
、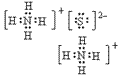
(5)共价化合物的电子式:画出离子最外层电子数: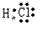 、
、
(6)用电子式表示物质形成的过程:
氯化氢的形成过程: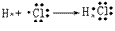
氯化镁的形成过程: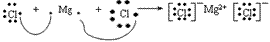
结构式:
共价键中的每一对共用电子用一根短线表示,未成键电子不写出,物质的电子式就变成了结构式。
例如: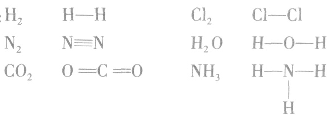
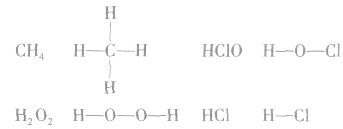
书写电子式的常见错误:
1.漏写未参与成键的电子,如: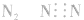
2.化合物类型不清,漏写或多写“[]”及错写电荷数,如: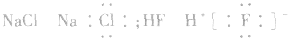
3.书写不规范,错写共用电子对如:N2的电子式为: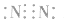 ,不能写成:
,不能写成: ,更不能写成:
,更不能写成: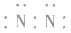 或
或 。
。
4.不考虑原子间的结合顺序如:HClO的电子式为 ,而非
,而非 。因氧原子需形成2对共用电子才能达到稳定结构,而H、 Cl各需形成1对共用电子就能达到稳定结构。
。因氧原子需形成2对共用电子才能达到稳定结构,而H、 Cl各需形成1对共用电子就能达到稳定结构。
5.不考虑原子最外层有几个电子均写成8电子结构如: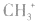 的电子式为
的电子式为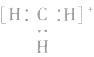 ,而非
,而非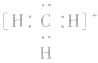 , 因
, 因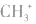 中碳原子最外层应有6个电子(包括共用电子),而非8个电子。
中碳原子最外层应有6个电子(包括共用电子),而非8个电子。
6.不清楚A如型离子化合物中两个B是分开写还是写一块如: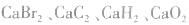 中
中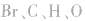 均为-l 价,Br-、H-已达到稳定结构,应分开写;C原子得一个电子,最外层有5个电子,需形成三对共用电子才能达到稳定结构,不能分开写;氧原子得一个电子,最外层有7个电子,需形成一对共用电子才能达到稳定结构,也不能分开写。它们的电子式分别为:
均为-l 价,Br-、H-已达到稳定结构,应分开写;C原子得一个电子,最外层有5个电子,需形成三对共用电子才能达到稳定结构,不能分开写;氧原子得一个电子,最外层有7个电子,需形成一对共用电子才能达到稳定结构,也不能分开写。它们的电子式分别为: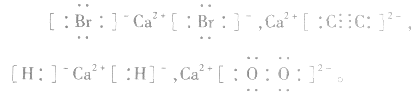
与“Q、W、X、Y、Z为5种短周期元素,且原子序数依次增大。W、X与Y...”考查相似的试题有:
- 科学家从化肥厂生产的(NH4)2SO4中检出组成N4H4(SO4)2的物质,经测定,该物质易溶于水,在水中以SO42-和N4H44+两种离子形式存...
- 下列说法不正确的是[ ]A.在共价化合物中一定含有共价键B.含有离子键的化合物一定是离子化合物C.含有共价键的化合物一定是...
- 下列物质的电子式书写正确的是( )A.Na2OB.H2SC.H2O2D.N2
- 下列化学用语正确的是[ ]A.S2-的原子结构示意图为B.碳—12可表示为12CC.—OH的电子式为D.NaCl的分子式为NaCl
- A、B、C、D、E、F、G七种物质中,其中A、D、E为单质,且D、E为气态,G为液态,它们之间存在如下转化关系:(1)当A、B的质量...
- 下列各项中表达正确的是 ( )A.H2O2的电子式:B.质量数为2的重氢原子:C.常温下,浓度都为0.1 mol/L的Na2CO3、NaHCO3溶液...
- a、b、c、d、e是短周期元素,周期表中a与b、b与c相邻;a与e的最外层电子数之比为2∶3,b的最外层电子数比e的最外层电子数少1个...
- 按要求填写下列有机化合物的相关化学式:(1)食醋中的主要有机物的结构简式____________________。(2)分子量最小的烃的电...
- 下列化学用语正确的是[ ]A.氯化钠的电子式B.乙炔的结构式H-C =C-HC.磷原子的结构示意图D.乙酸的分子式C2H4O2
- 按要求填空:(1)羟基的电子式是_____________;(2)(CH3CH2)2C(CH3)2的名称为_____________;(3)2-甲基-1,3-丁二烯的键...