本试题 “类推的思维方法在化学学习与研究中经常用到,但有时会产生错误的结论。因此,推出的结论最终要经过实践的检验才能决定其是否正确。以下几种类推结论中,不正...” 主要考查您对单质铝
四氧化三铁
镁的单质及其化合物
金属的冶炼
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 单质铝
- 四氧化三铁
- 镁的单质及其化合物
- 金属的冶炼
铝的主要性质:
- 物理性质:
铝是银白色,具有金属光泽的固体,硬度较小,具有良好的导电性、导热性和延展性。 - 化学性质:
活泼金属,具有较强的还原性;常温下铝在浓硫酸和浓硝酸中发生钝化;既可以与酸反应又可以与碱反应。
(1)与氧气反应: (纯氧中发出耀眼的白光)
(纯氧中发出耀眼的白光)
(2)与Cl2 、S 、N2反应: (Al2S3在溶液中完全双水解)
(Al2S3在溶液中完全双水解)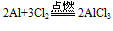
 (AlN与水反应生成Al(OH)3和NH3↑)
(AlN与水反应生成Al(OH)3和NH3↑)
(3)与水反应: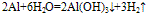
(4)与酸反应: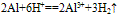
(5)与碱的反应:
(6)铝热反应:2Al+Fe2O3=(高温)=Al2O3+2Fe - 铝的用途
纯铝制作导线,铝合金用于制造飞机、汽车、生活用品等。
铝的特殊性质:
铝既能与酸反应,也能与强碱反应。
铝与酸反应:铝与浓硫酸在常温下发生钝化,2Al+6HCl==2AlCl3+3H2↑
铝与碱反应:2Al+2NaOH+2H2O==2NaAlO2+3H2↑
铝热反应:
铝热法是一种利用铝的还原性获得高熔点金属单质的方法。此种反应被称为铝热反应。
可简单认为是铝与某些金属氧化物(如Fe2O3、Fe3O4、Cr2O3、V2O5等)或非金属氧化物(如SiO2等)在高热条件下发生的反应。
铝热反应常用于冶炼高熔点的金属,并且它是一个放热反应,
其中镁条为引燃剂,氯酸钾为助燃剂。
其装置如下图所示: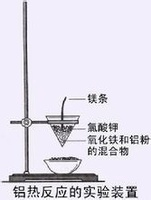
铝热反应配平技巧:
取反应物和生成物中氧化物中两边氧的最小公倍数,即可快速配平,如8Al+3Fe3O4=4Al2O3+9Fe中,可取Fe3O4和Al2O3中氧的最小公倍数12,则Fe3O4前应为3Al2O3前应为4,然后便可得到Al为8,Fe为9。
镁铝的化学性质比较:
| 单质 | 镁 | 铝 |
| 与非金属反应 | 2Mg+O2=(点燃)=2MgO (发出耀眼白光) Mg+Cl2=(点燃)=MgCl2 3Mg+N2=(点燃)=Mg3N2 |
4Al+3O2=(加热)=2Al2O3 2Al+3Cl2=(加热)=2AlCl3 2Al+3S=(加热)=Al2S3 |
| 与沸水反应 | Mg+2H2O=(加热)=Mg(OH)2+H2↑ | 不反应 |
| 与酸反应 | Mg+2H+==Mg2++H2↑ 与稀硝酸反应生成Mg(NO3)2、NOx(或者N2、NH4NO3)、H2O |
2Al+6H+==2Al3++3H2↑ 在冷的浓硝酸或浓硫酸中钝化 |
| 与氧化物反应 | 2Mg+CO2=(点燃)=2MgO+C (剧烈燃烧,生成白色粉末和黑色固体) |
2Al+Fe2O3=(高温)=2Fe+Al2O3(铝热反应) |
| 与盐溶液反应 | Mg+2NH4++2H2O==Mg2++2NH3·H2O+H2↑ Mg+Cu2+==Mg2++Cu |
2Al+3Hg2+=2Al3++3Hg |
| 与强碱反应 | 不反应 | 2Al+2OH-+2H2O==2AlO2-+3H2↑ |
铝热反应配平技巧:
取反应物和生成物中氧化物中两边氧的最小公倍数,即可快速配平,如8Al+3Fe3O4=4Al2O3+9Fe中,可取Fe3O4和Al2O3中氧的最小公倍数12,则Fe3O4前应为3Al2O3前应为4,底下便可得到Al为8,Fe为9。
铝与酸、碱反应的计算技巧:
铝与酸、碱反应的实质都是 ,
, ,所以根据得失电子守恒可知:
,所以根据得失电子守恒可知: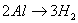 ,利用此关系可以方便地进行有关计算。
,利用此关系可以方便地进行有关计算。
铝与酸或碱溶液反应生成H2的量的计算:
Al是我们中学阶段学习的唯一既与H+反应也与OH-反应的金属,它与酸、碱反应既有相同点,也有不同点。
相同点:Al均被氧化成+3价,所以1molAl不论与H+还是与OH-反应均生成3gH2。
不同点:1molAl与H+反应消耗3molH+,而与OH-反应只消耗1molOH-,所以含有等物质的量的NaOH溶液和HCl溶液分别与足量的铝反应时生成的氢气的物质的量之比为3∶1。

“铝三角”关系:
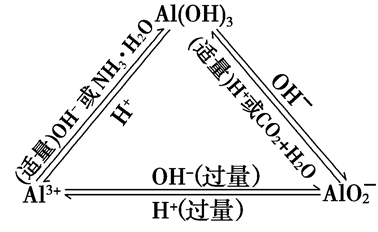
Al3++3OH-===Al(OH)3↓
Al(OH)3+OH-===AlO2-+2H2O
Al3++4OH-===AlO2-+2H2O
AlO2-+2H2O+CO2===Al(OH)3↓+HCO3-
AlO2-+H++H2O===Al(OH)3↓
AlO2-+4H+===Al3++2H2O
钝化:
铝、铁在常温下与浓硫酸发生钝化,钝化不是不反应,而是被氧化成一层致密的氧化物薄膜,恰恰说明金属的活泼性。
四氧化三铁:
又称磁性氧化铁,具有磁性的黑色晶体,不溶于水,具有优良的导电性。
四氧化三铁的性质:
(1)色态:具有磁性的黑色晶体
(2)别名:磁性氧化铁、氧化铁黑、磁铁、磁石、吸铁石、偏铁酸亚铁
(3)矿物:磁铁矿
(4)溶解性:不溶于水,与酸反应生成+2、+3铁盐
(5)稳定性:稳定
(6)还原性:在高温下,易氧化成三氧化二铁。4Fe3O4+O2 6Fe2O3
6Fe2O3
(7)氧化性:在高温下可与还原剂H2、CO、Al、C等反应。 


铁的氧化物:
| 化学式 | FeO | Fe2O3 | Fe3O4 |
| 俗称 | —— | 铁红 | 磁性氧化铁 |
| 色态 | 黑色粉末 | 红棕色粉末 | 黑色晶体 |
| 铁的价态 | +2 | +3 | +2、+3 |
| 水溶性 | 不溶 | 不溶 | 不溶 |
| 与酸反应 | FeO+2H+==Fe2++H2O | Fe2O3+6H+==2Fe3++3H2O | Fe3O4+8H+==Fe2++2Fe3++4H2O |
| 用途 | 玻璃色料 | 油漆、颜料 | 做颜料和抛光剂 |
| 氧化性 | 高温时都能与C、CO、H2反应,被还原生成Fe单质 | ||
镁:
化学式Mg,它是一种银白色的轻质碱土金属,化学性质活泼,能与酸反应生成氢气,具有一定的延展性和热消散性。镁元素在自然界广泛分布,是人体的必需元素之一,原子结构示意图: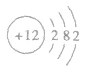 。
。
氧化镁:
化学式MgO是镁的氧化物,一种离子化合物。常温下为一种白色固体。氧化镁以方镁石形式存在于自然界中,是冶镁的原料。
氢氧化镁:
化学式Mg(OH)2,式量58.32。白色无定形粉末。难溶于水,易溶于稀酸和铵盐溶液。饱和水溶液的浓度为1.9毫克/升(18℃),呈碱性。加热到350℃失去水生成氧化镁。用做分析试剂,还用于制药工业。氧化镁跟水反应可得氢氧化镁。
镁及其化合物的物理性质和化学性质:
| 物理性质 | 化学性质 | |
| Mg | 银白色固体,密度1.738g﹒cm3-,熔点645℃,沸点1090℃,导电导热性较好,延展性较好 | ①镁和铝两元素的原子最外层分别有2个和3个电子。在参加化学反应时,容易失去最外层电子成为阳离子,表现还原性。 Mg-2e-==Mg2+ ②镁与非金属反应 O2+2Mg  2MgO 2MgOCl2+Mg  MgCl2 MgCl2 S+Mg  MgS MgS3Mg+N2  Mg3N2 Mg3N2 说明在常温下,镁能与空气里的氧气发生反应,生成一层致密的氧化物薄膜,从而使金属失去光泽。由于这层氧化物薄膜能阻止金属的继续氧化,所以镁有抗腐蚀性。 ③镁与酸反应 2HCl+Mg==MgCl2+H2↑ 2H++Mg==Mg2++H2↑ 镁跟硝酸、浓硫酸反应时,硝酸中的氮元素、硫酸中的硫元素被还原,不生成氢气。 ④镁跟某些氧化物反应 2Mg+CO2  C+2MgO C+2MgO ⑤镁跟水反应 Mg+2H2O  Mg(OH)2+H2↑ Mg(OH)2+H2↑ 说明:镁跟冷水反应非常缓慢. |
| MgO | 白色固体,离子化合物,熔点为3073K,硬度(莫氏)为6.5,难溶于水的固体,熔点很高,是很好的耐火材料 | 典型的碱性氧化物,不能与水反应 |
| Mg(OH)2 | 白色难溶于水的固体,其水溶液中c(OH-)很小,可以使酚酞溶液变成浅红色 Mg(OH)2(s)  Mg2+(aq)+2OH-(aq) Mg2+(aq)+2OH-(aq) |
①可与酸反应生成盐和水,如Mg(OH)2+2HCl==MgCl2+2H2O ②热稳定性差,受热容易分解 Mg(OH)2  MgO+H2O MgO+H2O |
工业制备镁:
电解熔融状态的氯化镁制取镁
阳极反应:2Cl--2e-==Cl2↑
阴极反应:Mg2++2e-==Mg
总反应:MgCl2(熔融) Mg+Cl2↑
Mg+Cl2↑
Mg2++2Cl-==Mg+Cl2↑
说明氧化镁比氯化镁熔点高,为了降低能耗,工业电解制取镁采用的原料是氯化镁而不是氧化镁。
氧化镁的应用:
氧化镁可用于染料,油漆,玻璃,化学试剂,医药,食品添加剂等方面,工业上利用MgO熔点高的特点,制造耐火材料。
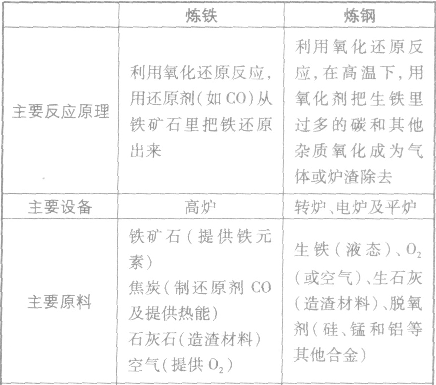
(1)把金属从化合态变为游离态。常用冶炼法:用碳一氧化碳氢气等还原剂与金属氧化物在高温下反应。
(2)冶炼的原理
①还原法:金属氧化物(与还原剂共热)--→游离态金属
②置换法:金属盐溶液(加入活泼金属)--→游离态金属
③火法冶炼(Pyrometallurgy)又称为干式冶金,把矿石和必要的添加物一起在炉中加热至高温,熔化为液体,生成所需的化学反应,从而分离出粗金属,然后再将粗金属精炼。
④湿式冶金(Hydrometallurgy) 湿法冶金这种冶金过程是用酸、碱、盐类的水溶液,以化学方法从矿石中提取所需金属组分,然后用水溶液电解等各种方法制取金属。此法主要应用在低本位、难熔化或微粉状的矿石。现在世界上有75%的锌和镉是采用焙烧-浸取-水溶液电解法制成的。这种方法已大部分代替了过去的火法炼锌。其他难于分离的金属如镍-钴,锆-铪,钽-铌及稀土金属都采用湿法冶金的技术如溶剂萃取或离子交换等新方法进行分离,取得显著的效果。
(3)常见金属冶炼:
①汞:热分解法:2HgO
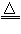 2Hg+O2(气体)
2Hg+O2(气体) ②铜:置换法:CuSO4+Fe==Cu+FeSO4(又叫湿法炼铜)
③铝:电解法:2Al2O3
 4Al+3O2(注意不能用AlCl3,因为AlCl3不是离子化合物)
4Al+3O2(注意不能用AlCl3,因为AlCl3不是离子化合物)④镁:电解法:MgCl2(l)
 Mg(s)+Cl2(g)↑
Mg(s)+Cl2(g)↑ ⑤钠:电解法:2NaCl
 2Na+Cl2↑
2Na+Cl2↑ ⑥钾:原理是高沸点金属制低沸点金属:Na+KCl==K+NaCl(反应条件是高温,真空。)
⑦铁:热还原法:2Fe2O3+3C
 2Fe+3CO2↑
2Fe+3CO2↑ 炼铁和炼钢的比较:

铝的冶炼:
(1)由铝土矿制氧化铝
①将铝土矿中的氧化铝水合物溶解在氢氧化钠溶液中: 
②向偏铝酸钠溶液中通入二氧化碳,析出氢氧化铝: 
③使氢氧化铝脱水生成氧化铝:
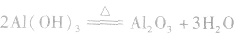
(2)电解氧化铝制备铝
电解时,以氧化铝、冰晶石(Na2AlF6)熔融液为电解质,其中也常加入少量的氟化钙等帮助降低熔点;阳极和阴极以碳素材料做成,在电解槽的钢板和阴极碳素材料之间还要放置耐火绝缘材料。
①主要设备——电解槽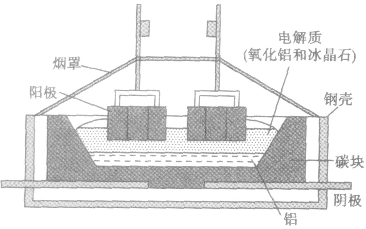
②电极反应式
阳极反应: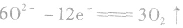
阴极反应: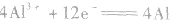
总反应:
与“类推的思维方法在化学学习与研究中经常用到,但有时会产生错...”考查相似的试题有:
- 明矾石是制取钾肥和氢氧化铝的重要原料,明矾石的组成和明矾相似,此外还含有氧化铝和少量氧化铁杂质。具体实验步骤如下图所...
- 混合物A中含有KAl(SO4)2·12H2O、Al2O3和Fe2O3,通过下图所示方法可分离回收Al2O3和Fe2O3:回答下列问题:(1) 滤渣Ⅰ的主要成...
- (1)写出工业上用过量CO2与偏铝酸钠溶液反应制氢氧化铝的离子方程式 。(2)写出乙醇、乙酸与浓硫酸加热反应的方程式 。
- 等质量的钠进行下列实验,其中生成氢气最多的是[ ]A.将钠投入到足量水中B.将钠用铝箔包好并刺一些小孔,再放入足量的水中C...
- 将等体积、等pH的NaOH溶液和NH·HO溶液,分别全部加入到甲、乙烧杯中。下列说法正确的是( )A.甲中沉淀一定比乙多B.乙中沉淀...
- 下列关于金属的叙述中正确的是( )A.常温下所有的金属都是固态B.金属具有导电、导热和延展性C.金属元素的原子只有还原性,...
- 请按要求分别设计一个简单易行的验证实验。(1)验证钠和镁的金属性强弱______________________________;(2)验证硫和氯的...
- Al(OH)3和Mg(OH)2的分解温度是200~300℃和340~ 490℃,与聚乙烯的分解温度比较接近,将上述两种氢氧化物添加于聚乙烯制品中可...
- 现代社会中铜在电气、交通、机械和冶金、能源及石化工业、高科技等领域有广泛的应用。某铜矿石含氧化铜、氧化亚铜、三氧化二...
- 【三选一—选修化学与技术】 (1)纯碱是一种重要的化工原料。目前制碱工业主要有“氨碱法”和“联合制碱法”两种工艺。 ①“氨碱法”产...