本试题 “工业合成氨与制备硝酸一般可连续生产,流程如下(1)①工业生产时,制取氢气的一个反应为:CO+H2O(g)⇌CO2+H2,850℃时,往1L密闭容器中充入0.3mol CO和0.2mol...” 主要考查您对盖斯定律
化学平衡的有关计算
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 盖斯定律
- 化学平衡的有关计算
盖斯定律的内容:
不管化学反应是一步完成还是分几步完成,其反应热是相同的。换句话说,化学反应的反应热只与反应的始态和终态有关,而与反应进行的途径无关。如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一一步完成时的反应热是相同的,这就是盖斯定律。
盖斯定律的意义:
利用盖斯定律可以间接计算某些不能直接测得的反应的反应热。例如: 的△H无法直接测得,可以结合下面两个反应的△H,利用盖斯定律进行计算。
的△H无法直接测得,可以结合下面两个反应的△H,利用盖斯定律进行计算。

根据盖斯定律,就可以计算出所给反应的△H。分析上述两个反应的关系,即知


盖斯定律在反应热大小比较中的应用:
1.同一反应生成物状态不同时

若按以下思路分析:

2.同一反应物状态不同时

3.两个有联系的不同反应相比

并且据此可写出下面的热化学方程式:


不管化学反应是一步完成还是分几步完成,其反应热是相同的。换句话说,化学反应的反应热只与反应的始态和终态有关,而与反应进行的途径无关。如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一一步完成时的反应热是相同的,这就是盖斯定律。
盖斯定律的意义:
利用盖斯定律可以间接计算某些不能直接测得的反应的反应热。例如:
 的△H无法直接测得,可以结合下面两个反应的△H,利用盖斯定律进行计算。
的△H无法直接测得,可以结合下面两个反应的△H,利用盖斯定律进行计算。
根据盖斯定律,就可以计算出所给反应的△H。分析上述两个反应的关系,即知


盖斯定律在反应热大小比较中的应用:
1.同一反应生成物状态不同时

若按以下思路分析:

2.同一反应物状态不同时

3.两个有联系的不同反应相比

并且据此可写出下面的热化学方程式:


化学平衡计算的一般思路和方法:
有天化学平衡的计算一般涉及各组分的物质的量、浓度、转化率、百分含量,气体混合物的密度、平均摩尔质量、压强等。通常的思路是写出反应方程式,列出相关量(起始量、变化量、平衡量),确定各量之间的火系,列出比例式或等式或依据平衡常数求解,这种思路和方法通常称为“三段式法”、如恒温恒压下的反应mA(g)+nB(g) pC(g)+ qD(g)
pC(g)+ qD(g)
(1)令A、B的起始物质的量分别为amol,bmol 达到平衡后,A的消耗量为m·xmol,容器容积为VL。
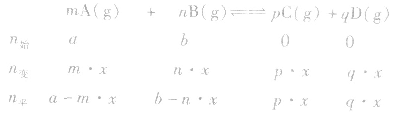
则有:

(2)对于反应物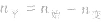 ,对于生成物
,对于生成物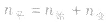
(3)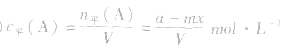
(4)A的转化率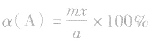
(5)平衡时A的体积(物质的量)分数
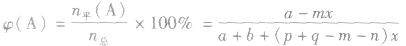
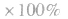
(6)
(7)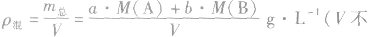
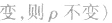
(8)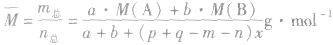
有天化学平衡的计算一般涉及各组分的物质的量、浓度、转化率、百分含量,气体混合物的密度、平均摩尔质量、压强等。通常的思路是写出反应方程式,列出相关量(起始量、变化量、平衡量),确定各量之间的火系,列出比例式或等式或依据平衡常数求解,这种思路和方法通常称为“三段式法”、如恒温恒压下的反应mA(g)+nB(g)
 pC(g)+ qD(g)
pC(g)+ qD(g) (1)令A、B的起始物质的量分别为amol,bmol 达到平衡后,A的消耗量为m·xmol,容器容积为VL。
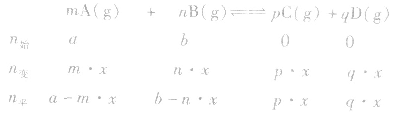
则有:

(2)对于反应物
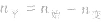 ,对于生成物
,对于生成物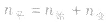
(3)
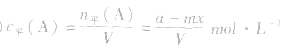
(4)A的转化率
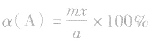
(5)平衡时A的体积(物质的量)分数
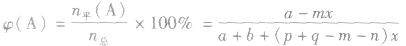
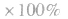
(6)

(7)
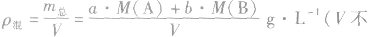
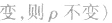
(8)
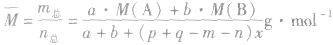
发现相似题
与“工业合成氨与制备硝酸一般可连续生产,流程如下(1)①工业生...”考查相似的试题有:
- 已知化学反应2C(s)+O2(g)2CO(g);2CO(g) + O2(g)2CO2(g)都是放热反应。据此推断,下列说法不正确的是(相同条件下)[ ]A.56g...
- (16分)金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝。高温下,在密闭容器中用H2还原WO3可得到金属钨,...
- 如图所示,当关闭K时,向A 中充入2molX、7molY,向B中充入4molX、14molY,起始时VA=VB=a升,在相同温度和有催化剂存在的条件...
- 在一定温度下,将一定质量的混合气体在密闭容器中发生反应aA(g)+bB(g)cC(g)+dD(g),达到平衡时测得B气体的浓度为0.6 mol/L,...
- 二甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效,具有优良的环保性能。也可替代氟利昂作制冷剂等,对臭氧层无破坏作用...
- 25℃时,在1L的密闭容器中充入NO2发生如下反应:2NO2(g)⇌N2O4(g)△H=-57kJ•mol-1(N2O4在25℃时为无色气体).(1)该反应的...
- 一定温度下在容积恒定的密闭容器中,进行如下可逆反应:A(s)+2B(g)C(g)+D(g),当下列物理量不发生变化时,能表明该反应已达到...
- 已知A、B、C是第二周期的非金属元素,其原子序数依次增大,且它们之间可以形成AC和BC以及AC2和BC2分子,D元素是一种短周期元...
- 恒温下,容积均为2L的密闭容器M、N中,分别有以下两种起始投料建立的可逆反应3A(g)+2B(g)2C(g)+xD(s)的化学平衡状态。相关数...
- 已知某可逆反应mA(g) + n B(g)pC(g)+ Q在密闭容器中进行,图中表示在不同反应时间t时,温度T和压强P与反应物B在混合气体中的...