本试题 “如图装置所示,铜片上发生的反应为A.Zn2++ 2e一=ZnB.2H++2e一= H2↑C.Zn一2e一=Zn2+D.Cu2++2e一= Cu” 主要考查您对原电池原理的应用
原电池的形成条件
原电池原理
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 原电池原理的应用
- 原电池的形成条件
- 原电池原理
(1)根据形成原电池判断金属的活动性根据活泼金属为负极,不活泼金属为正极,可通过组成原电池判断金属活动性。
(2)形成原电池可以加快反应速率纯锌与稀H2SO4反应速率较慢,当加入CuSO4溶液以后,反应速率加快,因为Zn+Cu2+=Cu+Zn2+析出的Cu与Zn接触,在稀H2SO4中形成原电池,加快反应速率。
(3)根据原电池原理可以判断电池的正负极、电解质溶液、判断溶液pH的变化
(4)根据原电池原理可以保护金属不被腐蚀
(5)判断金属腐蚀程度的快慢
原电池原理的应用:
1.比较不同金属的活动性强弱
根据原电池原理可知,在原电池反应过程中,一般活动性强的金属作负极,而活动性弱的金属(或能导电的非金属)作正极。
若有两种金属A和B,用导线将A和B连接后,插入到稀硫酸中,一段时间后,若观察到A极溶解,而B 极上有气体放出,说明在原电池工作过程中,A被氧化成阳离子而失去电子作负极,B作正极,则金属A的金属活动性比B强。
2.加快氧化还原反应的速率
因为形成原电池后,产生电位差,使电子的运动速率加快,从而使反应速率增大,如Zn与稀H2SO4反应制氧气时,可向溶液中滴加少量CuSO4溶液,形成Cu—Zn原电池,加快反应速率 3.用于金属的防护要保护一个铁制闸门,可用导线将其与一锌块相连,使锌作原电池的负极,铁制闸门作正极。
4.设计制作化学电源设计原电池时要紧扣构成原电池的条件。
(1)首先要将已知氧化还原反应拆分为两个半反应:
(2)然后根据原电池的电极反应特点,结合两个半反应找出正、负极材料(一般负极就是失电子的物质,正极用比负极活泼性差的金属或导电的非金属)及电解质溶液:
①电解质溶液的选择电解质溶液一般要能够与负极发生反应,或者能与电极产物发生反应。但如果两个半反应分别在两个容器中进行(中间连接盐桥),左右两个容器中的电解质溶液应选择与电极材料相同的阳离子。如在铜一锌一硫酸铜构成的原电池中,负极金属锌浸泡在含有 Zn2+“的电解质溶液中,而正极铜浸泡在含有Cu2+的溶液中.
②电极材料的选择在原电池中,选择较活泼的金属或还原性较强的物质作为负极,较不活泼的金属或能导电的非金属或氧化性较强的物质作为正极。一般,原电池的负极能够与电解质溶液反应,容易失去电子,因此负极一般是活泼的金属材料(也可以是还原性较强的非金属材料如H2、CH4等)。
(3)举例根据以下反应设计原电池: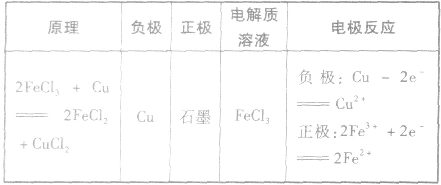
原电池的构成条件:
(1)活泼性不同的两个电极。
(2)电解质溶液,一般能与较活泼金属自发地进行氧化还原反应。
(3)形成闭合回路。
原电池中盐桥的作用:
盐桥中的盐溶液是电解质溶液(通常装有含琼胶的KCl饱和溶液),能使两烧杯中的溶液连成一个通路。通过盐桥中阴、阳离子的定向移动(阳离子移向正极,阴离子移向负极)维持两个半电池的电中性,以使原电池连续工作。盐桥将氧化还原反应的两个半反应隔开进行,能提高原电池的工作效率,减缓电流衰减。
1.定义:将化学能转化为电能的装置。
2.工作原理:
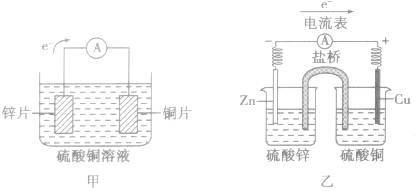
以铜-锌原电池为例

(1)装置图:
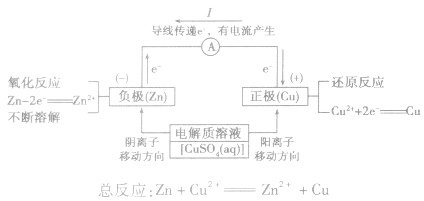
(2)原理图:
3.实质:化学能转化为电能。
4.构成前提:能自发地发生氧化还原反应。
5.电极反应:
负极:失去电子;氧化反应;流出电子
正极:得到电子;氧化反应;流入电子
6.原电池正负极判断的方法:
①由组成原电池的两级材料判断,一般是活泼金属为负极,活泼性较弱的金属或能导电的非金属为正极。
②根据电流方向或电子流动方向判断,电流是由正极流向负极,电子流动方向是由负极流向正极。
③根据原电池里电解质溶液内离子的定向移动方向,在原电池的电解质溶液中,阳离子移向正极,阴离子移向负极。
④根据原电池两级发生的变化来判断,原电池的负极总是失电子发生氧化反应,正极总是得电子发生还原反应。
⑤X极增重或减重:X极质量增加,说明溶液中的阳离子在X极(正极)放电,反之,X极质量减少,说明X极金属溶解,X极为负极。
⑥X极有气泡冒出:发生可析出氢气的反应,说明X极为正极。
⑦X极负极pH变化:析氢或吸氧的电极发生反应后,均能使该电极附近电解质溶液的pH增大,X极附近的pH增大,说明X极为正极。
原电池中的电荷流动:
在外电路(电解质溶液以外),电子(负电荷)由负极经导线(包括电流表和其他用电器)流向正极,使负极呈正电性趋势、正极呈负电性趋势。在内电路(电解质溶液中),阳离子(带正电荷)向正极移动,阴离子 (带负电荷)向负极移动。这样形成了电荷持续定向流动,电性趋向平衡的闭合电路。
与“如图装置所示,铜片上发生的反应为A.Zn2++ 2e一=ZnB.2H++...”考查相似的试题有:
- 镍氢电池的总反应为 H2+2NiO(OH)2Ni(OH)2,根据此反应式判断,此电池放电时,正极上发生反应的物质是( )。A.NiO(OH)B.Ni(O...
- 在如图所示的装置中,a为Fe,b为碳棒,关于此装置的各种叙述正确的是A.a电极上有气体放出,b电极上无气泡,溶液pH变大B.a是...
- 下列装置或操作能达到实验目的是( )A.实验室制氨气B.配制稀硫酸溶液C.构成铜锌原电池D.滴定FeSO4溶液
- 下列有关四个电化学装置的叙述正确的是A.图I装置中MnO2作催化剂B.图II装置工作一段时间后,滴加少量K3[Fe(CN)6]溶液,无明...
- TiO2在光照射下可使水分解:2H2O2H2↑+O2↑,该过程类似植物的光合作用。下图是光照射下TiO2分解水的装置示意图。下列叙述正确...
- 某兴趣小组的同学用下图所示装置研究有关电化学的问题(甲、乙、丙三池中溶质足量),当闭合该装置的开关K时,观察到电流计的指...
- 在下图中的8个装置中,属于原电池的是( )A.①④⑤B.③⑥⑧C.④⑥⑦D.⑥⑦⑧
- 现有如下两个反应:(A)NaOH + HCl =" NaCl" + H2O(B)2FeCl3+ Cu = 2FeCl2+ CuCl2(1)根据两反应本质,判断能否设计成原...
- 由铜片、锌片和200mL 稀H2SO4组成的原电池中,若锌片只发生电化学反应,则当铜片上共放出3.36L(标准状况)气体时,H2SO4恰好...
- 已知蓄电池在充电时作电解池,放电时作原电池。铅蓄电池上有两个接线柱,一个接线柱旁标有“+”,另一个接线柱旁标有“-”。关于...