本试题 “碳酸钠是造纸、玻璃、纺织、制革等行业的重要原料。工业碳酸钠(钝度约98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO42-等杂质,提纯工艺路线如下已知碳酸钠的溶解...” 主要考查您对盖斯定律
工业生产纯碱
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 盖斯定律
- 工业生产纯碱
盖斯定律的内容:
不管化学反应是一步完成还是分几步完成,其反应热是相同的。换句话说,化学反应的反应热只与反应的始态和终态有关,而与反应进行的途径无关。如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一一步完成时的反应热是相同的,这就是盖斯定律。
盖斯定律的意义:
利用盖斯定律可以间接计算某些不能直接测得的反应的反应热。例如: 的△H无法直接测得,可以结合下面两个反应的△H,利用盖斯定律进行计算。
的△H无法直接测得,可以结合下面两个反应的△H,利用盖斯定律进行计算。

根据盖斯定律,就可以计算出所给反应的△H。分析上述两个反应的关系,即知


盖斯定律在反应热大小比较中的应用:
1.同一反应生成物状态不同时

若按以下思路分析:

2.同一反应物状态不同时

3.两个有联系的不同反应相比

并且据此可写出下面的热化学方程式:


不管化学反应是一步完成还是分几步完成,其反应热是相同的。换句话说,化学反应的反应热只与反应的始态和终态有关,而与反应进行的途径无关。如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一一步完成时的反应热是相同的,这就是盖斯定律。
盖斯定律的意义:
利用盖斯定律可以间接计算某些不能直接测得的反应的反应热。例如:
 的△H无法直接测得,可以结合下面两个反应的△H,利用盖斯定律进行计算。
的△H无法直接测得,可以结合下面两个反应的△H,利用盖斯定律进行计算。
根据盖斯定律,就可以计算出所给反应的△H。分析上述两个反应的关系,即知


盖斯定律在反应热大小比较中的应用:
1.同一反应生成物状态不同时

若按以下思路分析:

2.同一反应物状态不同时

3.两个有联系的不同反应相比

并且据此可写出下面的热化学方程式:


工业生产纯碱:
纯碱(学名碳酸钠)实际上是盐,由于它在水中发生水解作用而使溶液呈碱性。纯碱易溶于水,呈强碱性,能提供
Na+离子。这些性质使它们被广泛地用于制玻璃、肥皂、纺织、印染、漂白、造纸、精制石油、冶金及其他化学工业等各部门中。
碳酸钠在自然界中存在相当广泛。一些生长在盐碱地和海岸附近的植物中含有碳酸钠,可以从植物的灰烬中提取;当冬季来临时,碱湖中所含的碳酸钠结晶析出,经过简单的加工就可以使用。
世界上最早是通过路布兰法实现了碳酸钠的工业生产。其生产原理是:
用硫酸将食盐转变成硫酸钠
NaCl+H2SO4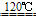 NaHSO4+HCl↑NaCl+NaHSO4
NaHSO4+HCl↑NaCl+NaHSO4 Na2SO4+HCl↑
Na2SO4+HCl↑
将硫酸钠与木炭、石灰石一起加热,反应生成碳酸钠和硫化钙
Na2SO4+2C Na2S+2CO2↑ Na2S+CaCO3
Na2S+2CO2↑ Na2S+CaCO3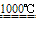 Na2CO3+CaS
Na2CO3+CaS
存在原料利用不充分、成本较高、设备腐蚀严重等
氨碱法生产硫酸:
氨碱法是由比利时人索尔维发明的,所以,氨碱法也称为索尔维制碱法。氨碱法的原料也是氯化钠和碳酸钙,不同的是它还使用了炼焦的副产品氨。
原料:CaCO3、NaCl、NH3
1.生成碳酸氢钠和氯气铵
将CO2通入含NH3的饱和NaCl溶液中
NH3+CO2+H2O==NH4HCO3 NaCl+NH4HCO3==NaHCO3↓+NH4Cl
2.抽取碳酸钠2NaHCO3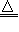 Na2CO3+CO2↑+H2O↑
Na2CO3+CO2↑+H2O↑
氨碱法生产原理:
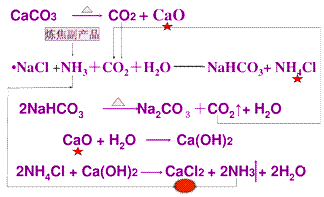
氨碱法的优点:原料便宜易得,氨和部分二氧化碳可循环利用,产品纯度高,步骤简单。氨碱法的缺点:副产物氯化钙的处理问题,氯化钠的利用率低。
联合制碱法:
我国化学侯德榜(下图)改革国外的纯碱生产工艺,生产流程可简要表示如下:

(1)上述生产纯碱的方法称联合制碱法或侯德榜制碱法,副产品的一种用途为化肥或电解液或焊药等。
(2)沉淀池中发生的化学反应方程式是NH3+CO2+H2O+NaCl=NH4Cl+NaHCO3↓或NH3+CO2+H2O=NH4HCO3 NH4HCO3+NaCl=NaHCO3↓+NH4Cl。
(3)写出上述流程中X物质的分子式CO2。
(4)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了I 的循环。从沉淀池中取出沉淀的操作是过滤
(5)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加稀硝酸和硝酸银溶液
(6)向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用是:
①增大NH4+的浓度,使NH4Cl更多地析出②使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
联合法综合利用了合成氨的原料,提高了氯化钠的利用率,减少了环境污染。
NH3、CO2都来自于合成氨工艺;这样NH4Cl就成为另一产品化肥。综合利用原料、降低成本、减少环境污染,NaCl利用率达96%。
纯碱(学名碳酸钠)实际上是盐,由于它在水中发生水解作用而使溶液呈碱性。纯碱易溶于水,呈强碱性,能提供
Na+离子。这些性质使它们被广泛地用于制玻璃、肥皂、纺织、印染、漂白、造纸、精制石油、冶金及其他化学工业等各部门中。
碳酸钠在自然界中存在相当广泛。一些生长在盐碱地和海岸附近的植物中含有碳酸钠,可以从植物的灰烬中提取;当冬季来临时,碱湖中所含的碳酸钠结晶析出,经过简单的加工就可以使用。
世界上最早是通过路布兰法实现了碳酸钠的工业生产。其生产原理是:
用硫酸将食盐转变成硫酸钠
NaCl+H2SO4
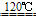 NaHSO4+HCl↑NaCl+NaHSO4
NaHSO4+HCl↑NaCl+NaHSO4 Na2SO4+HCl↑
Na2SO4+HCl↑ 将硫酸钠与木炭、石灰石一起加热,反应生成碳酸钠和硫化钙
Na2SO4+2C
 Na2S+2CO2↑ Na2S+CaCO3
Na2S+2CO2↑ Na2S+CaCO3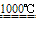 Na2CO3+CaS
Na2CO3+CaS 存在原料利用不充分、成本较高、设备腐蚀严重等
氨碱法生产硫酸:
氨碱法是由比利时人索尔维发明的,所以,氨碱法也称为索尔维制碱法。氨碱法的原料也是氯化钠和碳酸钙,不同的是它还使用了炼焦的副产品氨。
原料:CaCO3、NaCl、NH3
1.生成碳酸氢钠和氯气铵
将CO2通入含NH3的饱和NaCl溶液中
NH3+CO2+H2O==NH4HCO3 NaCl+NH4HCO3==NaHCO3↓+NH4Cl
2.抽取碳酸钠2NaHCO3
 Na2CO3+CO2↑+H2O↑
Na2CO3+CO2↑+H2O↑ 氨碱法生产原理:

氨碱法的优点:原料便宜易得,氨和部分二氧化碳可循环利用,产品纯度高,步骤简单。氨碱法的缺点:副产物氯化钙的处理问题,氯化钠的利用率低。
联合制碱法:
我国化学侯德榜(下图)改革国外的纯碱生产工艺,生产流程可简要表示如下:

(1)上述生产纯碱的方法称联合制碱法或侯德榜制碱法,副产品的一种用途为化肥或电解液或焊药等。
(2)沉淀池中发生的化学反应方程式是NH3+CO2+H2O+NaCl=NH4Cl+NaHCO3↓或NH3+CO2+H2O=NH4HCO3 NH4HCO3+NaCl=NaHCO3↓+NH4Cl。
(3)写出上述流程中X物质的分子式CO2。
(4)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了I 的循环。从沉淀池中取出沉淀的操作是过滤
(5)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加稀硝酸和硝酸银溶液
(6)向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用是:
①增大NH4+的浓度,使NH4Cl更多地析出②使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
联合法综合利用了合成氨的原料,提高了氯化钠的利用率,减少了环境污染。
NH3、CO2都来自于合成氨工艺;这样NH4Cl就成为另一产品化肥。综合利用原料、降低成本、减少环境污染,NaCl利用率达96%。
发现相似题
与“碳酸钠是造纸、玻璃、纺织、制革等行业的重要原料。工业碳酸...”考查相似的试题有:
- 在298 K 100 kPa时,已知:2H2O(g)=2H2(g)+O2(g) △H1Cl2(g)+H2(g)=2HCl(g) △H22Cl2(g)+2H2O(g)=4HCl(g)+O2(g) △H3则△H3与△H1...
- 已知:Fe2O3(s)+3/2C(s)=3/2CO2(g)+2Fe(s) △H= +234.1kJ·mol-1;C(s)+O2(g)=CO2(g) △H= -393.5kJ·mol-1。则2Fe(s)+3/2O2(g)=Fe...
- 已知:2Al (s)+3/2O2(g)=== Al2O3(s) △H= -1 644.3 kJ·mol-12Fe (s) +3/2O2(g)=== Fe2O3(s) △H= -815.88 kJ·mol-1试写出...
- 运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。(1)合成氨反应N2(g)+3H2(g)2NH3(g),若在恒温、恒压条件下...
- 把煤作为燃料可通过下列两种途径:途径Ⅰ:C(s)+O2(g)CO2(g) (1mol碳单质反应放热Q1 kJ)途径Ⅱ:先制水煤气 C(s)+H2O(g)CO(g)+H...
- 在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污...
- 能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。(1)工业上一般采用下列两种反应合成...
- 合成氨反应N2(g)+3H2(g)2NH3(g) ΔH=-94.2kJ·mol-1,分别在反应条件不同,但体积均为2L的三个固定体积的容器中反应,起始时...
- 海水是一种丰富的资源,工业上从海水中可提取NaCl、Na2CO3、Mg等多种物质,这些物质广泛应用于生产、生活等领域.如图所示是...
- 我国化学侯德榜(右图)改革国外的纯碱生产工艺,生产流程可简要表示如下:(1)上述生产纯碱的方法称______,副产品的一种用...