本试题 “甲醇广泛用作燃料电池的燃料,可由天然气来合成,已知:①2CH4(g)+O2(g)=2CO(g)+4H2(g) △H=-71 kJ/mol②CO(g)+2H2( g)=CH3OH(l) △H=-90.5 kJ/mol下列说法不正确...” 主要考查您对吸热反应、放热反应
盖斯定律
原电池原理
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 吸热反应、放热反应
- 盖斯定律
- 原电池原理
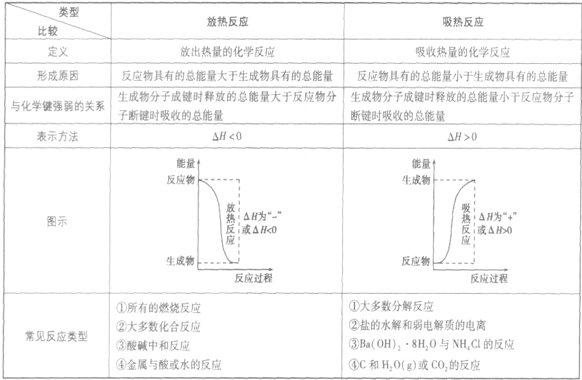
吸热反应:
吸收热量的反应,即生成物的总能量大于反应物的总能量,反应需要吸收能量
放热反应:
放出热量的反应,即生成物的总能量小于反应物的总能量,反应释放出能量
放热反应和吸热反应的比较:
吸收热量的反应,即生成物的总能量大于反应物的总能量,反应需要吸收能量
放热反应:
放出热量的反应,即生成物的总能量小于反应物的总能量,反应释放出能量
放热反应和吸热反应的比较:

盖斯定律的内容:
不管化学反应是一步完成还是分几步完成,其反应热是相同的。换句话说,化学反应的反应热只与反应的始态和终态有关,而与反应进行的途径无关。如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一一步完成时的反应热是相同的,这就是盖斯定律。
盖斯定律的意义:
利用盖斯定律可以间接计算某些不能直接测得的反应的反应热。例如: 的△H无法直接测得,可以结合下面两个反应的△H,利用盖斯定律进行计算。
的△H无法直接测得,可以结合下面两个反应的△H,利用盖斯定律进行计算。

根据盖斯定律,就可以计算出所给反应的△H。分析上述两个反应的关系,即知


盖斯定律在反应热大小比较中的应用:
1.同一反应生成物状态不同时

若按以下思路分析:

2.同一反应物状态不同时

3.两个有联系的不同反应相比

并且据此可写出下面的热化学方程式:


不管化学反应是一步完成还是分几步完成,其反应热是相同的。换句话说,化学反应的反应热只与反应的始态和终态有关,而与反应进行的途径无关。如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一一步完成时的反应热是相同的,这就是盖斯定律。
盖斯定律的意义:
利用盖斯定律可以间接计算某些不能直接测得的反应的反应热。例如:
 的△H无法直接测得,可以结合下面两个反应的△H,利用盖斯定律进行计算。
的△H无法直接测得,可以结合下面两个反应的△H,利用盖斯定律进行计算。
根据盖斯定律,就可以计算出所给反应的△H。分析上述两个反应的关系,即知


盖斯定律在反应热大小比较中的应用:
1.同一反应生成物状态不同时

若按以下思路分析:

2.同一反应物状态不同时

3.两个有联系的不同反应相比

并且据此可写出下面的热化学方程式:


原电池:
1.定义:将化学能转化为电能的装置。
2.工作原理:
以铜-锌原电池为例
(1)装置图:

(2)原理图:

3.实质:化学能转化为电能。
4.构成前提:能自发地发生氧化还原反应。
5.电极反应:
负极:失去电子;氧化反应;流出电子
正极:得到电子;氧化反应;流入电子
6.原电池正负极判断的方法:
①由组成原电池的两级材料判断,一般是活泼金属为负极,活泼性较弱的金属或能导电的非金属为正极。
②根据电流方向或电子流动方向判断,电流是由正极流向负极,电子流动方向是由负极流向正极。
③根据原电池里电解质溶液内离子的定向移动方向,在原电池的电解质溶液中,阳离子移向正极,阴离子移向负极。
④根据原电池两级发生的变化来判断,原电池的负极总是失电子发生氧化反应,正极总是得电子发生还原反应。
⑤X极增重或减重:X极质量增加,说明溶液中的阳离子在X极(正极)放电,反之,X极质量减少,说明X极金属溶解,X极为负极。
⑥X极有气泡冒出:发生可析出氢气的反应,说明X极为正极。
⑦X极负极pH变化:析氢或吸氧的电极发生反应后,均能使该电极附近电解质溶液的pH增大,X极附近的pH增大,说明X极为正极。
1.定义:将化学能转化为电能的装置。
2.工作原理:
以铜-锌原电池为例

(1)装置图:

(2)原理图:

3.实质:化学能转化为电能。
4.构成前提:能自发地发生氧化还原反应。
5.电极反应:
负极:失去电子;氧化反应;流出电子
正极:得到电子;氧化反应;流入电子
6.原电池正负极判断的方法:
①由组成原电池的两级材料判断,一般是活泼金属为负极,活泼性较弱的金属或能导电的非金属为正极。
②根据电流方向或电子流动方向判断,电流是由正极流向负极,电子流动方向是由负极流向正极。
③根据原电池里电解质溶液内离子的定向移动方向,在原电池的电解质溶液中,阳离子移向正极,阴离子移向负极。
④根据原电池两级发生的变化来判断,原电池的负极总是失电子发生氧化反应,正极总是得电子发生还原反应。
⑤X极增重或减重:X极质量增加,说明溶液中的阳离子在X极(正极)放电,反之,X极质量减少,说明X极金属溶解,X极为负极。
⑥X极有气泡冒出:发生可析出氢气的反应,说明X极为正极。
⑦X极负极pH变化:析氢或吸氧的电极发生反应后,均能使该电极附近电解质溶液的pH增大,X极附近的pH增大,说明X极为正极。
原电池中的电荷流动:
在外电路(电解质溶液以外),电子(负电荷)由负极经导线(包括电流表和其他用电器)流向正极,使负极呈正电性趋势、正极呈负电性趋势。在内电路(电解质溶液中),阳离子(带正电荷)向正极移动,阴离子 (带负电荷)向负极移动。这样形成了电荷持续定向流动,电性趋向平衡的闭合电路。
发现相似题
与“甲醇广泛用作燃料电池的燃料,可由天然气来合成,已知:①2CH4...”考查相似的试题有:
- 把下列物质分别加入装有水的锥形瓶里,立即塞紧带U形管的塞子,已知U形管内预先装有少量水(为使水容易观察,预先染成红色)...
- 已知反应:H2(g)+ 1/2O2(g)=H2O(g) △H11/2N2(g)+O2(g)=NO2(g) △H21/2N2(g)+3/2H2(g)=NH3(g) △H3则反...
- 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。根据上图回...
- 电化学原理在工业生产中有着重要的作用,请利用所学知识回答有关问题。(1)用电解的方法将硫化钠溶液氧化为多硫化物的研究具...
- 某课外活动小组同学用如图装置进行实验,试回答下列问题:(1) 若开始时开关K与a连接,则B极的电极反应式为__________________...
- 下列装置能构成原电池的是( )A.B.C.D.
- 右图是某学生设计的一个原电池,若要装置中电流计发生偏转,则M、N两极的组成材料是 ( )A.Zn、ZnB.Zn、CuC.Cu、CuD.石...
- 已知铅蓄电池的总反应PbO2+Pb +2H2SO4="=" 2PbSO4+ 2H2O ,图为铁铆钉铆在铜板上,有关叙述不正确的是A.铅蓄电池放电时,...
- 如图所示a、b都是惰性电极,通电一段时间后,a极附近溶液显红色。下列说法中正确的是( )A.X是正极,Y是负极B.U型管中溶液PH...
- 根据图回答,下列说法正确的是( )A.若a为粗铜,b为纯铜,X为CuSO4,该装置可用于铜的精炼B.若a为纯铁,b为纯铜,X为CuSO4...