本试题 “下列关于实验的叙述正确的是[ ]A.向煮沸的1 mol/L NaOH溶液中滴加饱和FeCl3溶液制备Fe(OH)3胶体B.直接观察焰色反应,火焰为浅紫色,则一定不含Na元素C.若...” 主要考查您对金属的焰色反应
中和热的测定
氯气的制取
氢氧化铁(胶体)的制备
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 金属的焰色反应
- 中和热的测定
- 氯气的制取
- 氢氧化铁(胶体)的制备
金属的焰色反应:
(1)有些金属或它们的化合物在灼烧时会使火焰呈现出特色的颜色的想象。
(2)操作:
①洗:用盐酸洗去铂丝表面的杂质
②烧:将铂丝在酒精灯火焰上灼烧至于酒精灯颜色一致
③蘸:蘸取试样
④烧:在火焰上灼烧
⑤观:观察火焰颜色(若检验钾要透过钴玻璃观察)
(3)常见的颜色反应
Li Na K Ca Sr Ba Cu
紫红 黄 紫(透过蓝色钴玻璃片) 砖红 洋红 黄绿 绿
①焰色反应为物理变化过程。
②焰色现象与金属元素的存在有关,与物质组成无关。如:钠元素的焰色为黄色,包括钠单质以及钠的所有化合物。
(1)有些金属或它们的化合物在灼烧时会使火焰呈现出特色的颜色的想象。
(2)操作:
①洗:用盐酸洗去铂丝表面的杂质
②烧:将铂丝在酒精灯火焰上灼烧至于酒精灯颜色一致
③蘸:蘸取试样
④烧:在火焰上灼烧
⑤观:观察火焰颜色(若检验钾要透过钴玻璃观察)
(3)常见的颜色反应
Li Na K Ca Sr Ba Cu
紫红 黄 紫(透过蓝色钴玻璃片) 砖红 洋红 黄绿 绿
①焰色反应为物理变化过程。
②焰色现象与金属元素的存在有关,与物质组成无关。如:钠元素的焰色为黄色,包括钠单质以及钠的所有化合物。
中和热测定:
(1)目的:①用量热法测定HCl与NaOH的中和热。②了解化学标定法,并掌握其操作。
(2)原理:在298K、溶液足够稀的情况下,1molOH-与1molH+中和,可放出57.3.kJ的热量。即:H+(aq)+OH-(aq) =H2O(aq) △H=-57.3kJ/mol
(3)仪器和实验:大烧杯(500 mL)、小烧杯(100 mL)、温度计、量筒(50mL)两个、泡沫塑料或纸条、泡沫塑料板或硬纸板(中心有两个小孔)、环形玻璃搅拌棒。0.50 mol/L 盐酸、0.55 mol/L NaOH溶液。
(4)步骤:
①在大烧杯底垫泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平。然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过,以达到保温、隔热、减少实验过程中热量损失的目的,如图所示。该实验也可在保温杯中进行。
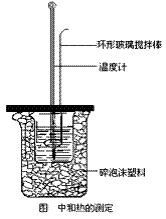
②用一个量筒量取50mL0.50mol/L盐酸,倒入小烧杯中,并用温度计测量盐酸的温度,记入下表。然后把温度计上的酸用水冲洗干净。
③用另一个量筒量取50mL 0.55 mol/L NaOH溶液,并用温度计测量NaOH溶液的温度,记入下表。
④把温度计和环形玻璃搅拌棒放入小烧杯的盐酸中,并把量筒中的NaOH溶液一次倒入小烧杯(注意不要洒到外面)。用环形玻璃搅拌棒轻轻搅动溶液,并准确读取混合溶液的最高温度,记为终止温度,记入下表。
⑤重复实验两次,取测量所得数据的平均值作为计算依据。
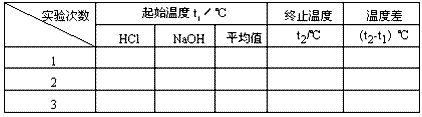
⑥根据实验数据计算中和热。
(1)目的:①用量热法测定HCl与NaOH的中和热。②了解化学标定法,并掌握其操作。
(2)原理:在298K、溶液足够稀的情况下,1molOH-与1molH+中和,可放出57.3.kJ的热量。即:H+(aq)+OH-(aq) =H2O(aq) △H=-57.3kJ/mol
(3)仪器和实验:大烧杯(500 mL)、小烧杯(100 mL)、温度计、量筒(50mL)两个、泡沫塑料或纸条、泡沫塑料板或硬纸板(中心有两个小孔)、环形玻璃搅拌棒。0.50 mol/L 盐酸、0.55 mol/L NaOH溶液。
(4)步骤:
①在大烧杯底垫泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平。然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过,以达到保温、隔热、减少实验过程中热量损失的目的,如图所示。该实验也可在保温杯中进行。

②用一个量筒量取50mL0.50mol/L盐酸,倒入小烧杯中,并用温度计测量盐酸的温度,记入下表。然后把温度计上的酸用水冲洗干净。
③用另一个量筒量取50mL 0.55 mol/L NaOH溶液,并用温度计测量NaOH溶液的温度,记入下表。
④把温度计和环形玻璃搅拌棒放入小烧杯的盐酸中,并把量筒中的NaOH溶液一次倒入小烧杯(注意不要洒到外面)。用环形玻璃搅拌棒轻轻搅动溶液,并准确读取混合溶液的最高温度,记为终止温度,记入下表。
⑤重复实验两次,取测量所得数据的平均值作为计算依据。

⑥根据实验数据计算中和热。
氯气的实验室制法:
(1)实验室用浓盐酸和二氧化锰反应制取氯气。 
(2)装置图: 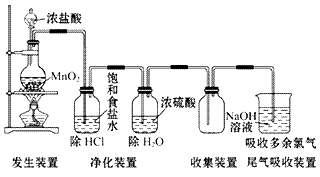
(3) 步骤: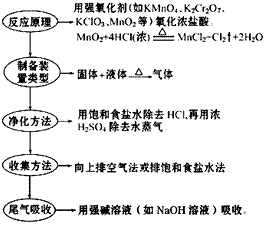

氯气的工业制法:
(1)电解饱和食盐水(氯碱工业),化学方程式为: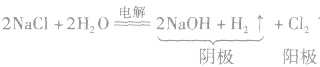
(2)电解熔融的氯化钠(可制得金属蚋),化学方程式为:
(3)电解熔融的氯化镁(可制得金属镁),化学方程式为:
氢氧化铁胶体的制备:
(1)氢氧化铁胶体的制备:
往100mL烧杯中加入50mL水并加热至沸腾,向沸水滴加几滴饱和氯化铁溶液,继续煮沸至溶液呈红褐色,即停止加热。
注意:
(1)实验过程不能用玻璃棒搅拌,否则溶液出现浑浊;
(2)当反应体系呈现红褐色,即制得氢氧化铁胶体,应立即停止加热,否则也容易出现浑浊,产生红褐色的氢氧化铁沉淀。
(2)氢氧化铁的制备:
①原理:FeCl3+3NaOH=Fe(OH)3↓+3NaCl
②操作方法:向试管里注入少量氯化铁溶液,再逐滴滴入氢氧化钠溶液,观察现象。
③现象:有红褐色沉淀产生。
(1)氢氧化铁胶体的制备:
往100mL烧杯中加入50mL水并加热至沸腾,向沸水滴加几滴饱和氯化铁溶液,继续煮沸至溶液呈红褐色,即停止加热。
注意:
(1)实验过程不能用玻璃棒搅拌,否则溶液出现浑浊;
(2)当反应体系呈现红褐色,即制得氢氧化铁胶体,应立即停止加热,否则也容易出现浑浊,产生红褐色的氢氧化铁沉淀。
(2)氢氧化铁的制备:
①原理:FeCl3+3NaOH=Fe(OH)3↓+3NaCl
②操作方法:向试管里注入少量氯化铁溶液,再逐滴滴入氢氧化钠溶液,观察现象。
③现象:有红褐色沉淀产生。
发现相似题
与“下列关于实验的叙述正确的是[ ]A.向煮沸的1 mol/L NaOH溶液...”考查相似的试题有:
- 下列实验方案设计正确的是[ ]A.分解高锰酸钾制氧气后,残留在试管内壁上的黑色物质可用稀盐酸洗涤B.失去标签的硝酸银溶液、...
- 下列有关物质性质的运用错误的是①Na2O2与CO2反应放出氧气:矿山、坑道等供呼吸之用 ②各种金属单质特殊的焰色:节日焰火 ③三聚...
- 已知实验室制取H2S的实验原理为FeS(块状)+H2SO4===FeSO4+H2S↑。根据下图中A~D 的实验装置和试剂进行实验:(1)装置A是由双...
- 由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色的纯净Fe(OH)2沉淀。应用如图7-5电解装置可制得白色...
- (16分)下图是某化工厂对海水资源的综合利用的示意图。(1)目前国际上实用的“海水淡化”主要技术之一是蒸馏法。蒸馏法是将海...
- (13分)下表是实验室制备气体的有关内容:编号实验内容实验原理气体发生装置①[制备氧气H2O2→O2 ②制备氨气NH4Cl→NH3 ③制备氯...
- 实验室制取氯气的装置如图1:(1)装置F的名称是______;按图组装好装置后首先要进行的操作是:______.(2)装置B中盛放的试...
- 下列实验操作正确的是( )A.中和滴定实验时,锥形瓶用蒸馏水洗净,烘干后才能使用B.中和热的测定实验中,读取混合溶液的最...
- 实验室制取干燥的下列气体,收集方法和使用的干燥剂可以完全相同的是A.H2和CO2B.CO2和O2C.Cl2和NH3D.NH3和O2
- 制备、分离和提纯物质是化学研究的一个重要内容,下列有关说法正确的是A.分馏和蒸馏的原理相同,且都为物理变化B.木炭和焦...