本试题 “下列对于物质性质与用途关系的叙述,错误的是( )A.硫酸铜溶液具有杀菌作用,可用于饮用水消毒B.稀有气体在通电时能发出不同颜色的光,可制成多种用途的电...” 主要考查您对化学元素和人体健康
空气的成分
乳化和乳化作用
物理性质和化学性质的区别和应用
金属的化学性质
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 化学元素和人体健康
- 空气的成分
- 乳化和乳化作用
- 物理性质和化学性质的区别和应用
- 金属的化学性质
在人体中元素的存在形式:
①碳、氢、氧、氮主要以水、糖类、蛋白质、维生素和脂肪的形式存在。
②其他的元素主要以无机盐的形式存在于水溶液中。
③钙元素主要以羟基磷酸钙[Ca10(PO4)6(OH)2] 晶体的形式存在。
常量元素:
常量元素人体中含量较多的元素有11种,它们约占人体质量的99.95%。在人体中含量超过0.01%的元素,称为常量元素。
①人体中的常量元素
| 元素名称 | 元素符号 | 质量分数% |
| 氧 | O | 65.0 |
| 碳 | C | 18.0 |
| 氢 | H | 10.0 |
| 氮 | N | 3.0 |
| 钙 | Ca | 2.0 |
| 磷 | P | 1.0 |
| 钾 | K | 0.35 |
| 硫 | S | 0.25 |
| 钠 | Na | 0.15 |
| 氯 | Cl | 0.15 |
| 镁 | Mg | 0.05 |
②一些常量元素在人体中的作用及每天适宜摄入量
| 钙 | 使骨骼和牙街具有坚硬的结构支架 | 800—1200mg | 缺钙主要影响骨骼的发育和结构,临床症状表现为青少年的佝偻病和成年人的骨质软化症及老年人的骨质疏松症。钙是无毒的元素,但摄入过量会导致高血钙,从而引起消化系统、泌尿系统等的疾病 | 海产品、豆类、奶类、各种绿叶蔬菜等 | 其中99%存在于骨骼和牙齿中,主要以羟基磷酸钙 [Ca10(PO4)6(OH)2晶体的形式存在 |
| 钠 | 细胞外液和细胞内液中的Na+和K+各自保持一定的浓度,维持人体内的水分和体液恒定的pH | 2000—2500mg | 缺钠会引起肌肉痉挛、头痛等;过量会引起水肿、高血压、贫血等 | 食盐 | 其中一半以Na+的形式存在于细胞外液中 |
| 钾 | 1850—5600mg | 缺钾会引起肌肉不发达、心律小齐等;过量会导致恶心、腹泻等 | 香蕉、柑橘、橙子、山楂、蘑菇、豆炎及其制品等 | 主要以K+的形式萍在干细胞内液中 | |
| 镁 | 促进骨骼发育、细胞遗传物质合成等 | 300—400mg | 缺镁会引起肌肉不发达、抽搐、痉挛、心律不齐等;过量会引起神经系统紊乱、肾病等 | 坚果、大豆、牛奶等 | 70%的镁以磷酸盐和碳酸盐形式参与骨骼和牙齿的组成,25%的镁存在于软组织中 |
微量元素:
在人体中含量在0.01%以下的元素。
①一些人体必需的微量元素
| 元素名称 | 元素符号 |
| 铁 | Fe |
| 钴 | Co |
| 铜 | Cu |
| 锌 | Zn |
| 铬 | Cr |
| 锰 | Mn |
| 钼 | Mo |
| 氟 | F |
| 碘 | I |
| 硒 | Se |
②一些必需微量元素对人体的作用及14—18岁人群每天的适宜摄入量
| 元素 | 人体内的含量 | 对人体的作用 | 适宜摄入量(每天) | 摄入量过高,过低对人体健康的影响 |
| 铁 | 4—5g | 是血红蛋白的成分,能帮助氧气的运输 | 20—50mg | 缺铁会引起贫血 |
| 锌 | 2.5g | 影响人体发育 | 15.5—19mg | 缺锌会引起食欲不振,生长迟缓,发育不良 |
| 硒 | 14—21mg | 有防癌、抗癌作用 | 50μg | 缺硒可能引起表皮角质化和癌症。如摄入量过高,会使人中毒 |
| 碘 | 25—50mg | 是甲状腺激素的重要成分 | 150μg | 缺碘会引起甲状腺肿大,幼儿缺碘会影响生长发育,造成思维迟钝。过量也会引起甲状腺肿大 |
| 氟 | 2.6g | 能防治龋齿 | 1.5mg | 缺氟易产生龋齿,过量会引起氟斑牙和氟骨病 |
知识拓展:
如果人体所需的元素仅从食物中摄取还不足时,可通过食品添加剂和保健药剂来予以补充。
如在食品巾添加含钙、锌、硒、锗的化合物,或制成补钙、补锌等的保健药剂或制成加碘食盐,来增加对这些元素的摄人量。但要注意即使是人体必需的元素,也要注意适宜的摄入量,摄人量过高和过低对人体健康都有不良的影响。
空气的成分:
氧气,二氧化碳,氢气,氮气,稀有气体;按体积分:N2占78%,O2占21%,稀有气体占0.94%,二氧化碳占0.03%,其他气体和杂质占0.03%。
易错点:
空气中各成分的含量在一定时间和一定范围内基本恒定,但随着人类活动的延续,气体的排放,空气的成分也在不停地变化,因此不能认为空气的成分是一成不变的。
氧气,二氧化碳,氢气,氮气,稀有气体;按体积分:N2占78%,O2占21%,稀有气体占0.94%,二氧化碳占0.03%,其他气体和杂质占0.03%。
易错点:
空气中各成分的含量在一定时间和一定范围内基本恒定,但随着人类活动的延续,气体的排放,空气的成分也在不停地变化,因此不能认为空气的成分是一成不变的。
乳化和乳化作用的概念:
1. 乳化现象:
乳浊液不稳定,静置分层,在乳浊液中加人洗涤剂以后,油虽然并没有溶解在水中,但这时形成的乳浊液却能均匀、稳定地存在而不分层,这种现象叫乳化现象。
“乳化”形成的并不是溶液,例如植物油中加入水,加入乳化剂并不是水溶解了油,只是使植物油分散成无数细小的液滴存在于水中而不聚集。
2. 乳浊液:小液滴分散到液体里形成的混合物。
3. 乳化作用:
乳蚀液的稳定剂是一类表面活性剂,阻止小液滴相互凝结。洗涤剂能把植物油分散成无数细小的液滴而不聚集成大的油珠,洗涤剂所起的作用就是乳化作用,使植物油分散成无数细小的液滴存在于水中而不聚集。
用汽油去油污与用洗涤剂洗去油污的不同:
利用汽油和洗涤剂均能除一去油污,但二者除去油污的原理不同。汽油溶解油污时形成溶液,但加了洗涤剂的水清洗油污是把油污分散成细小的液滴,使其形成乳浊液,再随着水漂走。
除去织物上污渍的方法:
乳化作用在生活中的应用:
①洗涤:用乳化剂(洗涤剂)可以将衣服上、餐具上的油污洗掉,如肥皂、洗洁精等。
②农药的使用:在农药中加入一定量的乳化剂后. 再溶解在有机溶剂里,混合均匀制成的透明液体叫乳油。
1. 乳化现象:
乳浊液不稳定,静置分层,在乳浊液中加人洗涤剂以后,油虽然并没有溶解在水中,但这时形成的乳浊液却能均匀、稳定地存在而不分层,这种现象叫乳化现象。
“乳化”形成的并不是溶液,例如植物油中加入水,加入乳化剂并不是水溶解了油,只是使植物油分散成无数细小的液滴存在于水中而不聚集。
2. 乳浊液:小液滴分散到液体里形成的混合物。
3. 乳化作用:
乳蚀液的稳定剂是一类表面活性剂,阻止小液滴相互凝结。洗涤剂能把植物油分散成无数细小的液滴而不聚集成大的油珠,洗涤剂所起的作用就是乳化作用,使植物油分散成无数细小的液滴存在于水中而不聚集。
用汽油去油污与用洗涤剂洗去油污的不同:
利用汽油和洗涤剂均能除一去油污,但二者除去油污的原理不同。汽油溶解油污时形成溶液,但加了洗涤剂的水清洗油污是把油污分散成细小的液滴,使其形成乳浊液,再随着水漂走。
除去织物上污渍的方法:
| 污渍 | 清洗方法 |
| 蓝墨水 | 白色织物上,可用草酸低稀溶液和漂白剂溶液轮流擦拭,再用洗涤剂和水洗;有色织物上,小心用高锰酸钾溶液擦拭,污渍去掉后,迅速用过氧化氢稀溶液擦拭污渍处,并立即用水漂洗 |
| 圆珠笔油 | 用酒精擦拭,再用洗涤剂洗,最后用水洗 |
| 菜汤,乳汁 | 用酒精擦拭,然后用稀氨水揉搓,再用水洗 |
| 水果渍 | 用氯化钠溶液洗,或用草酸稀溶液沾湿,再用水洗;如果是白色织物,可用过氧化氢稀溶液沾湿,再用水洗 |
| 血渍 | 刚沾上时,立即用冷水洗,再用洗涤剂洗,最后用水洗;沾污时间较长的,可用氨水擦拭,片刻后用冷水洗,如不能除净,用草酸稀溶液洗涤,然后用水洗 |
| 铁锈 | 草酸稀溶液清洗,然后用水洗 |
| 沥青 | 用酒精或汽油擦拭多次,然后用水洗 |
乳化作用在生活中的应用:
①洗涤:用乳化剂(洗涤剂)可以将衣服上、餐具上的油污洗掉,如肥皂、洗洁精等。
②农药的使用:在农药中加入一定量的乳化剂后. 再溶解在有机溶剂里,混合均匀制成的透明液体叫乳油。
物理性质:
1. 概念: 不需要发生化学变化就直接表现出来的性质。
2. 实例:在通常状态下,氧气是一种无色,无味的气体。
3. 物质的物理性质:如颜色,状态,气味,熔点,沸点,硬度等。
化学性质:
1. 概念:物质在化学变化中表现出来的性质,如铁在潮湿的空气中生成铁锈,铜能在潮湿的空气中生成铜绿。化学性质只能通过化学变化表现出来。
物质的性质和用途的关系:
若在使用物质的过程中,物质本身没有变化,则是利用了物质的物理变化,物质本身发生了变化,变成了其他物质,则是利用了物质的化学性质。物质的性质与用途的关系:物质的性质是决定物质用途的主要因素,物质的用途体现物质的性质。
物质的性质与物质的变化的区别和联系
| 物质的性质 | 物质的变化 | |
| 区别 | 物质的性质是指物质的特有属性,不同的物质其属性不同,是变化的内因 | 物质的变化是一个过程,是有序的,动态的,性质的具体体现 |
| 联系 | 物质的性质决定了它能发生的变化,而变化又是性质的具体表现 | |
判断是“性质”还是“变化”:
判断某种叙述是指物质的“性质”还是“变化”时,首先要准确把握它们的区别和联系,若叙述中有“能”,“难”,“易”,“会”,“就”等词语,往往指性质,若叙述中有“已经”,“了”,“在”等词语,往往指物质的变化。
有关描述物质的词语:
1. 物理性质:
(1)熔点
物质从固态变成液态叫熔化,物体开始熔化时的温度叫熔点。
(2)沸点
液体沸腾时的温度叫沸点。
(3)压强
物体在单位面积上所受到的压力叫压强。
(4)密度
物质在单位体积上的质量叫密度,符号为p。
(5)溶解性
一种物质溶解在另一种物质里的能力,称为这种物质的溶解性。溶解性跟溶质、溶剂的性质及温度等因素有关。
(6)潮解
物质在空气中吸收水分,表面潮湿并逐渐溶解的现象。如固体、NaOH,精盐在空气中易潮解。
(7)挥发性
物质由固态或液态变为气体或蒸气的过程二如浓盐酸具有挥发性,可挥发出氯化氢气体
(8)导电性
物体传导电流的能力叫导电性:固体导电靠的是白由移动的电子,溶液导电依靠的是自由移动的离子
(9)导热性
物体传导热量的能力叫导热性。一般导电性好的材料,其导热性也好。
(10)延展性
物体在外力作用下能延伸成细丝的性质叫延性;在外力作用下能碾成薄片的性质叫展性。二者合称为延展性,延展性一般是金属的物理性质之一。
2. 化学性质:
(1)助燃性物质在一定的条件下能进行燃烧的性质。如硫具有可燃性。
(2)助燃性物质能够支持燃烧的性质。如氧气具有助燃性
(3)氧化性在氧化还原反应中,能够提供氧元素的性质
(4)还原性在氧化还原反应中,能够夺取含氧化合物中氧元素的性质,初中化学常见的还原性物质(即还原剂)有 H2、CO、C。
(5)酸碱性酸碱性是指物质能够使酸碱指示剂变色的性质: 酸性溶液能使紫色石蕊变红,碱性溶液能使紫色石蕊变蓝。
(6)稳定性物质不易与其他物质发生化学反应或自身不易发生分解反应的性质,如稀有气体化学性质稳定。
(7)风化结晶水合物(如Na2CO3·10H2O)在干燥的环境中失去结晶水的性质。
金属的化学性质:
常见金属能与氧气反应,也能与盐酸,硫酸及盐溶液反应。
常见金属的化学性质:
1.金属和氧气的反应
2.金属与酸的反应
3.金属与盐的反应
将锌片、铁丝、铜丝三种金属分别放入硫酸铜溶液、硝酸银溶液、氯化钠溶液中,观察现象
易错点:
一、(1)一般在金属活动性顺序表中排在氢前面的金属(也叫活泼金属)能置换出酸中的氢;排在氢后面的金属则不能,如铜、银与盐酸、稀硫酸都不反应。
(2)浓硫酸和硝酸与金属反应不生成氢气,因为它们有很强的氧化性,与金属反应不生成氢气。
(3)在金属活动性顺序表中排在最前面的金属如K、 Na活泼性太强,放入酸溶液中首先跟酸发生置换反应,过M的金属会继续跟水发生剧烈的反应。
(4)铁与非氧化性酸反应时,始终生成亚铁盐 (Fe2+)。
(5)金属与酸反应后溶液的质量增大。
二、
(1)在金属活动性顺序表中,位于前面的金属可以把位于其后面的金属从它们的盐溶液中置换出来(K,Ca,Na除外)。相隔越远,反应越容易发生。
(2)金属与盐溶液的反应,盐必须能溶于水,不溶性的盐与金属不反应,如AgCl难溶于水,Fe和AgCl不反应。
(3)不能用活泼的金属K,Ca,Na,与盐溶液反应,因为K,Ca,Na。会先与H2O发生置换反应生成碱和氢气。
金属与酸的反应不一定属于置换反应:
置换反应是指一种单质和一种化合物反应生成另一种单质和另一种化合物的反应。一般情况下,较活泼的金属跟酸发生的化学反应属于置换反应。但由于浓硫酸(或硝酸)具有强氧化性,金属与浓硫酸(或硝酸)反应时,生成物相对比较复杂。这类反应不属于置换反应。
铝和锌的抗腐蚀性:
1.铝制品具有很好的抗腐蚀性,是因为铝与空气中的氧气反应表面生成一种致密的氧化铝薄膜,对铝起防护作用。
2.锌与铝的抗腐蚀性相似,也是在金属表面会生成一层致密的氧化锌保护膜。
常见金属能与氧气反应,也能与盐酸,硫酸及盐溶液反应。
常见金属的化学性质:
1.金属和氧气的反应
| 金属 | 在空气中 | 在氧气中 | 方程式 |
| 镁 | 常温下表面逐渐变暗。点燃 剧烈燃烧,发出耀眼的白光, 生成白色固体 |
点燃,剧烈燃烧,发出耀 眼的白光,生成白色固体 |
2Mg+O2 2MgO 2MgO |
| 铝 | 常温下,铝表而变暗,生成一 层致密氧化膜,保护铝不再被腐蚀 |
点燃。剧烈燃烧,火星四射, 放出大量的热,生成白色固体 |
4Al+3O2 2Al2O3 2Al2O3 |
| 铁 | 持续加热发红,离火变冷 | 火星四射,放出大量的热, 生成黑色固体 |
3Fe+2O2 Fe3O4 Fe3O4 |
| 铜 | 加热,生成黑色物质,在潮湿的 空气中,生成铜绿而被腐蚀 |
加热,生成黑色固体 | 2Cu+O2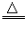 2CuO 2CuO |
| 金 | 即使在高温也不和氧气反应 | —— | |
| 结论 | 大多数金属都能喝氧气反应,但反应的难易程度和剧烈程度不同 | ||
2.金属与酸的反应
| 盐酸 | 稀硫酸 | 反应现象(两种酸中相同) | |
| 镁 | Mg+2HCl==MgCl2+H2↑ | Mg+H2SO4==MgSO4+H2↑ | 反应比较剧烈,产生大量 气泡,溶液仍为无色,生成 的气体能够燃烧,并且产 生淡蓝色火焰 |
| 铝 | 2Al+6HCl==2AlCl3+3H2↑ | 2Al+3H2SO4==Al2(SO4)+3H2↑ | |
| 锌 | Zn+2HCl==H2↑+ZnCl2 | Zn+H2SO4==ZnSO4+H2↑ | 反应缓慢,有气泡产生,溶 液由无色逐渐变为浅绿色, 生成的气体能够燃烧,并且 产生淡蓝色火焰 |
| 铁 | Fe+2HCl==FeCl2+H2↑ | Fe+H2SO4==FeSO4+H2↑ | |
| 铜 | 不反应 | 不反应 | 无 |
3.金属与盐的反应
将锌片、铁丝、铜丝三种金属分别放入硫酸铜溶液、硝酸银溶液、氯化钠溶液中,观察现象
| CuSO4溶液 | AgNO3溶液 | NaCl溶液 | |
| 锌 | 锌表面有一层红色金属析出,溶液由蓝色变为无色 Zn+CuSO4==ZnSO4+Cu |
锌表面有一层银白色金属析出 Zn+2AgNO3==Zn(NO3)2+2Ag |
无变化,不反应 |
| 铁 | 铁表面有一层红色金属析出,溶液由蓝色变为浅绿色 Fe+CuSO4==FeSO4+Cu |
铁表面有一层银白色金属析出,溶液由无色变为浅绿色 Fe+2AgNO3==Fe(NO3)2+2Ag |
无变化,不反应 |
| 铜 | 无变化,不反应 | 铜表面有一层银白色金属析出,溶液由无色变为蓝色 Cu+2AgNO3==Cu(NO3)2+2Ag |
无变化,不反应 |
易错点:
一、(1)一般在金属活动性顺序表中排在氢前面的金属(也叫活泼金属)能置换出酸中的氢;排在氢后面的金属则不能,如铜、银与盐酸、稀硫酸都不反应。
(2)浓硫酸和硝酸与金属反应不生成氢气,因为它们有很强的氧化性,与金属反应不生成氢气。
(3)在金属活动性顺序表中排在最前面的金属如K、 Na活泼性太强,放入酸溶液中首先跟酸发生置换反应,过M的金属会继续跟水发生剧烈的反应。
(4)铁与非氧化性酸反应时,始终生成亚铁盐 (Fe2+)。
(5)金属与酸反应后溶液的质量增大。
二、
(1)在金属活动性顺序表中,位于前面的金属可以把位于其后面的金属从它们的盐溶液中置换出来(K,Ca,Na除外)。相隔越远,反应越容易发生。
(2)金属与盐溶液的反应,盐必须能溶于水,不溶性的盐与金属不反应,如AgCl难溶于水,Fe和AgCl不反应。
(3)不能用活泼的金属K,Ca,Na,与盐溶液反应,因为K,Ca,Na。会先与H2O发生置换反应生成碱和氢气。
金属与酸的反应不一定属于置换反应:
置换反应是指一种单质和一种化合物反应生成另一种单质和另一种化合物的反应。一般情况下,较活泼的金属跟酸发生的化学反应属于置换反应。但由于浓硫酸(或硝酸)具有强氧化性,金属与浓硫酸(或硝酸)反应时,生成物相对比较复杂。这类反应不属于置换反应。
铝和锌的抗腐蚀性:
1.铝制品具有很好的抗腐蚀性,是因为铝与空气中的氧气反应表面生成一种致密的氧化铝薄膜,对铝起防护作用。
2.锌与铝的抗腐蚀性相似,也是在金属表面会生成一层致密的氧化锌保护膜。
发现相似题
与“下列对于物质性质与用途关系的叙述,错误的是( )A.硫酸铜...”考查相似的试题有:
- 下列说法或做法中正确的是A.电器设备着火立即用水扑灭B.在煤火上搁一壶水可防止煤气中毒C.通过燃烧法可区分羊毛、棉纤维及...
- 感受化学与人体健康的密切关系.下列说法中不正确的是( )A.食用鸡蛋可补充蛋白质B.缺钙会引起贫血C.食用黄瓜可补充维生...
- 化学与健康--从化学的视角看食品添加剂近年来,食品添加剂成了国内外食品安全与健康饮食的焦点问题,三聚氰胺、瘦肉精、染色...
- 将零散的化学知识进行梳理、归纳,会使你的头脑变得更聪明.下列归纳全部正确的是( )A.化学元素与人体健康的关系:缺铁元...
- 空气中,氧气所占的体积分数大约是( )A.15B.14C.45D.12
- 学习化学能让我们更好的认世界和了解生活。下列有关化学与生活的说法中正确的是[ ]A.掏空沼气池前进行灯火试验B.推广使用聚乙...
- 下列有关物质性质和用途关系的叙述,错误的是( )A.由于氢气燃烧,能出大量的热,所以可用作燃料B.烧碱极易吸收水分,可用...
- 物质的下列性质中属于物理性质的是( )A.可燃性B.酸碱性C.氧化性D.挥发性
- (1)影响物质性质的因素有:A.离子的种类不同 B.分子的构成不同 C.溶质的质量分数不同请从中选择导致下列物质性质差异的...
- 除去下列物质中的少量杂质,所选用试剂或方法不正确的是( )选项物 质杂 质试剂或方法AKNO3溶液Ba(NO3)2Na2SO4溶液BCaO固...