本试题 “下列化合物中,既有离子键,又有极性共价键和配位键的是( )A.硝酸B.氢氧化钠C.氯化铵D.三氧化硫” 主要考查您对配合物理论
极性键、非极性键
离子键
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 配合物理论
- 极性键、非极性键
- 离子键
配位键、配合物:
1.配位键配位键是一种特殊的共价键。成键的两个原子间的共用电子对是由一个原子单独提供的。形成配位键的条件是其中一个原子有孤电子对,另一个原子有接受孤电子对的“空轨道”。配位键用A→B表示,A是提供孤电子对的原子,B是接受孤电子对的原子。
2.配合物通常把金属离子(或原子)与某些分子或离子(称为配体)以配位键结合形成的化合物称为配合物。
3.配位键的形成
(1) 中配位键的形成
中配位键的形成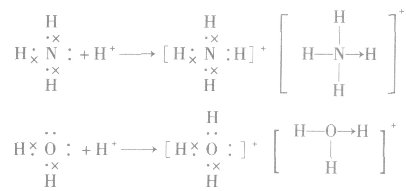
注意:结构式中“→”表示配位键及其共用电子对的提供方式。
(2)配离子 中配位键的形成
中配位键的形成
在 里,NH3分子中的氮原子给出孤电子对,
里,NH3分子中的氮原子给出孤电子对,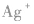 接受电子对,以配位键形成了
接受电子对,以配位键形成了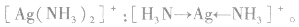
(3)配离子 的形成
的形成
在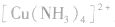 里,
里, 分子中的氮原子给出孤电子对,
分子中的氮原子给出孤电子对, 接受电子对,以配位键形成了
接受电子对,以配位键形成了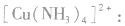
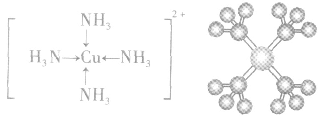
4.配合物的组成
配合物的组成包含中心原子、配体和配位原子、配位数,内界和外界等。以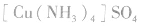 为例说明,如下图所示:
为例说明,如下图所示: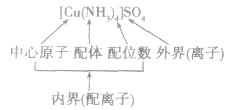
配合物的内界和外界之间多以离子键结合,因而属于离子化合物、强电解质,能完全电离成内界离子和外界离子,内界离子也能电离但程度非常小,可谓“强中有弱”。例如,配合物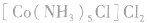 溶液中加入
溶液中加入 溶液,外界的
溶液,外界的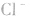 能被沉淀,而内界的
能被沉淀,而内界的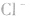 不能形成沉淀。
不能形成沉淀。
(1)非极性键:同种元素的原子间形成的共价键(共用电子对不偏移,成键原子双方不显电性)。
如:在非金属单质(H2 Cl2 O2)、共价化合物(H2O2 多碳化合物)、离子化合物(Na2O2 CaC2)中存在。
(2)极性键:不同元素的原子间形成的共价键(共用电子对偏向吸引电子能了强的一方,该元素显负价,偏离吸引电子能力弱的一方,该元素显正价)。如:在共价化合物(HCl H2O CO2 NH3)、某些离子化合物(NaOH Na2SO4 NH4Cl)中存在。
分子空间构型、键的极性与分子的极性:

化学键与物质类别:
1.只含有极性共价键的物质:一般是不同非金属元素构成的共价化合物。例如: 等。
等。
2.只含非极性共价键的物质:同种非金属元素构成的单质。例如: 、金刚石等。
、金刚石等。
3.既有极性键又有非极性键的物质。例如: 等。
等。
4.只含有离子键的物质:活泼非金属元素与活泼金属元素形成的化合物。例如: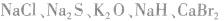 等。
等。
5.既有离子键又有非极性键的物质。例如: 等。
等。
6.既有离子键又有极性键的物质。例如: 等。
等。
7.由离子键、共价键、配位键构成的物质。例如: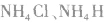 等。
等。
8.只含有共价键而无范德华力的物质。例如:金刚石、晶体硅、 等原子晶体。
等原子晶体。
9.由强极性键构成但又不是强电解质的物质。例如:HF。
10.没有化学键的物质。例如:稀有气体(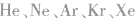 等)。
等)。
定义:
使阴阳离子结合成化合物的静电作用叫离子键。
成键元素:
活泼金属(或NH4+)与活泼的非金属或酸根离子、OH-
静电作用:
指静电吸引和静电排斥的作用
与“下列化合物中,既有离子键,又有极性共价键和配位键的是( )...”考查相似的试题有:
- A、B、C、D、E为前四周期元素,它们核电荷数依次递增。已知:A是元素周期表中原子半径最小的元素;B原子核外有两个未成对电子...
- 下列分子中,具有极性键的非极性分子的组合是[ ]A.H2、NH3、H2SB.CS2、BF3、CO2C.CH3Cl、CH2Cl、CH4D.SO2、NO2、C2H2
- 在①H2O2、②NaOH、③CaF2、④Na2O2中,只含有离子键的是(本题填编号)__________,既含有极性共价键又含有离子键的是__________...
- 科学家最近研制出可望成为高效火箭推进剂的N(NO2)3(如下图所示)。已知该分子中N-N-N键角都是108.1°,下列有关N(NO2)3的说法...
- 下列元素两两结合形成的化合物既有以离子键相结合的又有以共价键相结合的是( )A.H O KB.Mg K ClC.C H OD.Mg N Ne
- 叠氮酸钠(NaN3)是抗禽流感药物“达菲”合成过程中的中间活性物质。(1)NaN3中存在的化学键有________________(答案可能不止...
- Ⅰ铂(Pt)单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。(1...
- 下列物质中,既含有离子键,又含有非极性键的是[ ]A.NaOHB.Na2O2C.MgCl2D.H2O2
- 原子序数依次增大的四种短周期元素A、B、C、D,其中A与D同主族,B与C同周期,A、D原子的最外层电子数都是1,B原子最外层电子...
- 只有在化合物中才能存在的化学键是[ ]A.离子键B.共价键C.非极性键D.极性键