本试题 “氮化铝(AlN)是一种新型无机材料,广泛应用于集成电路生产领域.某氮化铝中含有碳或氧化铝杂质,现用图I中的一些装置来进行检验,使氮化铝样品和NaOH溶液反...” 主要考查您对氨气
测定物质组成、成分含量
通过实验装置图判断实验的可行性
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 氨气
- 测定物质组成、成分含量
- 通过实验装置图判断实验的可行性
氨:
NH3的电子式为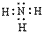 ,结构式为
,结构式为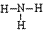 ,氨分子的结构为三角锥形,N原子位于锥顶,三个H原子位于锥底,键角107°18′,是极性分子。 分子结构为:
,氨分子的结构为三角锥形,N原子位于锥顶,三个H原子位于锥底,键角107°18′,是极性分子。 分子结构为: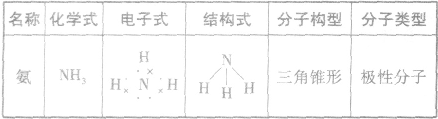
氨的物理性质和化学性质:
1.物理性质:
氨是无色、有刺激性气味的气体,比空气轻;氨易液化,在常压下冷却或常温下加压,气态氨转化为无色的液态氨,同时放出大量热。液态氨气化时要吸收大量的热,使周围的温度急剧下降;氨气极易溶于水,在常温、常压下,1体积水中能溶解约700体积的氨气(因此,氨气可进行喷泉实验);氨对人的眼、鼻、喉等粘膜有刺激作用,若不慎接触过多的氨而出现病症,要及时吸入新鲜空气和水蒸气,并用大量水冲洗眼睛。
2.化学性质:
(1)与水反应, ,氨的水溶液叫做氨水。在氨水中所含的微粒有:
,氨的水溶液叫做氨水。在氨水中所含的微粒有:
 氨水具有碱的通性,如能使无色酚酞溶液变红。
氨水具有碱的通性,如能使无色酚酞溶液变红。
(2)与酸反应生成铵盐反应实质为:
反应原理拓展NH3分子中N原子有一对孤电子,能够跟有空轨道的H+形成配位键: 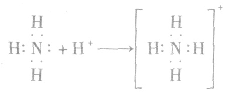
(3)具有还原性  (工业制HNO3的基础反应)
(工业制HNO3的基础反应) (Cl2过量)
(Cl2过量) (NH3过量,可用于检验Cl2瓶是否漏气)
(NH3过量,可用于检验Cl2瓶是否漏气)  (实验室制N2)
(实验室制N2)
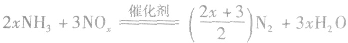 (治理氮氧化物污染)
(治理氮氧化物污染)
(4)与CO2反应制尿素 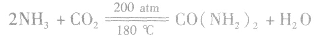
(5)配合反应
 的比较:
的比较:
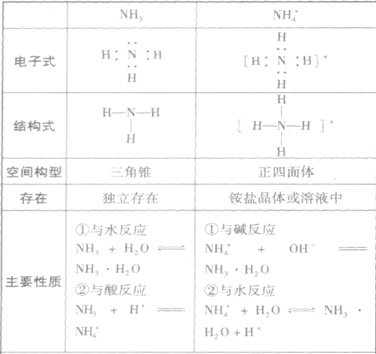
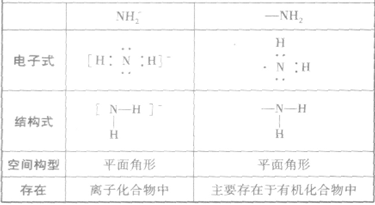
氨的结构与性质的关系总结:

氨的用途:
(1)氨是氮肥工业及制造硝酸、铵盐、纯碱等的重要原料。
(2)氨也是有机合成工业(如制尿素、合成纤维、染料等)上的常用原料。
(3)氨还可用作制冷剂。
对实验室制氨气常见问题的解释:
l.制取氨气时为什么用的铵盐一般是氯化铵而不是硝铵、硫铵或碳铵实验室制氨气用 固体混合反应,加热时反应速率显著增大。因为
固体混合反应,加热时反应速率显著增大。因为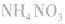 在加热时可能发生爆炸性的分解反应:
在加热时可能发生爆炸性的分解反应: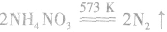
 ,若用硝铵代替,在制氨气过程中可能会发生危险;因为碳铵受热极易分解出CO2:,使生成的NH3中混有较多CO2杂质,故不用碳铵;若用硫铵,由于反应时生成
,若用硝铵代替,在制氨气过程中可能会发生危险;因为碳铵受热极易分解出CO2:,使生成的NH3中混有较多CO2杂质,故不用碳铵;若用硫铵,由于反应时生成 ,易使反应混合物结块,产生的氨气不易逸出。故制NH3时选用
,易使反应混合物结块,产生的氨气不易逸出。故制NH3时选用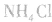 。
。
2.不用铵盐与强碱反应能否制取氨气能。
①加热浓度在20%以上的浓氨水,若浓度不够可加人适量固体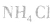 和生石灰(CaO)或烧碱:
和生石灰(CaO)或烧碱: 
②将浓氨水滴入盛有固体烧碱或生石灰(CaO)的烧瓶中,使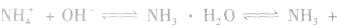
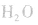 平衡右移,放出
平衡右移,放出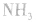 ,且NaOH、CaO溶于水均放热,可降低
,且NaOH、CaO溶于水均放热,可降低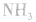 ,在水中的溶解度。
,在水中的溶解度。
③将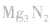 溶于水或使尿素在碱性条件下水解。
溶于水或使尿素在碱性条件下水解。 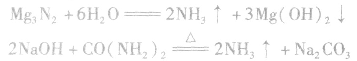
3.为什么制NH3用Ca(OH)2而不用NaOH ①固体NaOH易吸湿结块,不易与铵盐混合充分而反应;②在加热条件下,NaOH易腐蚀玻璃仪器。
4.制NH3的装置有哪些注意事项
①收集装置和发生装置的试管和导管必须是干燥的,因为氨气易溶于水;
②发生装置的试管口略向下倾斜,以免生成的水倒流使试管炸裂;
③导管应插入收集装置的底部,以排尽装置中的空气;
④收集NH3的试管口塞一团棉花,作用是防止NH3与空气形成对流,使收集的NH3较纯,还可防止NH3逸散到空气中。
5.用什么方法收集NH3只能用向下排空气法,因为NH3极易溶于水,密度又比空气小。
6.怎样收集干燥的NH3将NH3通过盛有碱石灰或固体NaOH的干燥管,但不能选用浓 、无水
、无水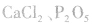 等作干燥剂,因为它们均能与NH3发生反应。
等作干燥剂,因为它们均能与NH3发生反应。
7.怎样检验NH3已充满试管把湿润的红色石蕊试纸放在试管口处,若试纸变蓝,则NH3已充满;把蘸有浓盐酸的玻璃棒接近试管口,若产生大量白烟,则NH3已充满。
定量实验介绍:

燃烧法测定氨基酸的组成:
实验室用燃烧法测定某种氨基酸(CxHyOzNp)的分子组成。取Wg该种氨基酸放在纯氧中充分燃烧,生成CO2、H2O和N2。现按下图所示装置进行实验。

①实验开始时,首先要通入一段时间的氧气,目的是排除体系中的N2。
②D装置的作用是吸收未反应的O2,保证最终收集的气体是N2。
③读取N2体积时,应注意:量筒内液面与广口瓶中的液面相持平视线与凹液面最低处相切。
④实验中测得N2的体积为VmL(已折算为标准状况)。为确定此氨基酸的分子式,还需要的有关数据为生成二氧化碳气体的质量、生成水的质量、氨基酸的相对分子质量
用氨气还原氧化铜的方法测定铜的近似相对原子质量:
实验室用氨气还原氧化铜的方法测定铜的近似相对原子质量,反应的化学方程式为:2NH3+3CuO
 N2+3Cu+3H2O
N2+3Cu+3H2O(1)如果选用测定反应物CuO和生成物H2O的质量[m(CuO)、m(H2O)]时,请用下列仪器设计一个简单的实验方案。
装置图:
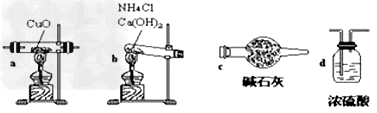
①连接顺序为:bcacd
②d中浓硫酸的作用是吸收未反应的氨、防止空气中水分进入;实验完毕时观察到a中的现象是固体由黑色转变为红色;
③Cu的相对原子质量的表达式
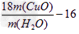
1.红磷转换成白磷装置图
2.氨气易溶于水(喷泉实验)

3.氯化铵受热分解
4.铵盐与碱反应
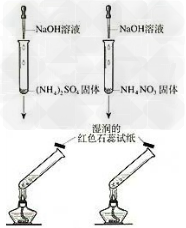
5.实验室制取氨气装置图

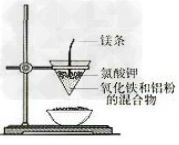
6.铝热反应实验装置
7.铁与水蒸气反应实验装置图

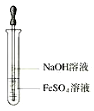
8.氢氧化亚铁的生成
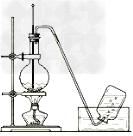
9.实验室制取乙烯的装置图
10.乙烯使高锰酸钾、溴水褪色

11.乙炔的制取和燃烧
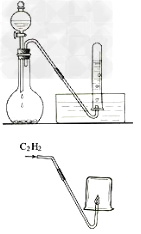
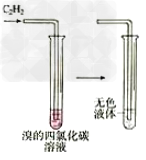
12.乙炔使溴水褪色
13.苯不能使高锰酸钾褪色

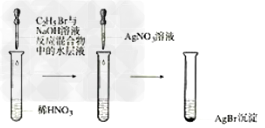
14.溴乙烷的水解反应
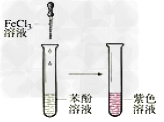
15.苯酚的显色反应
16.乙酸乙酯的制备

17.油脂的水解
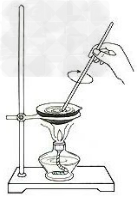
18.中和热的测定
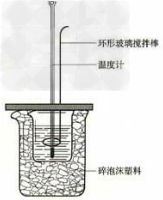
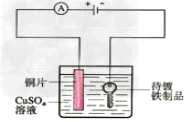
19.电镀铜实验装置
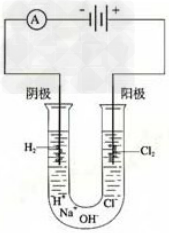
20.点解饱和食盐水
与“氮化铝(AlN)是一种新型无机材料,广泛应用于集成电路生产领...”考查相似的试题有:
- 在下图装置中,烧瓶中充满干燥气体a,将胶头滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体呈喷泉状...
- 实验室在制备气体时,对某些气体来说,收集方法即可采用排水法,又可采用排空气法收集,下列气体中,能同时采用上述两种收集...
- X、Y、Z、W的转化关系如图所示,则 X、Y可能是[ ]①C、CO ②NH3、NO ③Fe、Fe(NO3)2④AlCl3、Al(OH)3A.①②③B.②③④C.①③④D.①②③④
- 某同学为了探究氯气与氨气的反应,设计了如图所示,装置B中装饱和食盐水,C中装浓硫酸,E中装碱石灰。实验过程中观察到D中产...
- 某化学学习小组同学对实验室制取氨气和氨气的还原性等进行了以下探究,请你参与并完成对有关问 题的解答。[资料获悉]①氨气与C...
- 下图为某套实验装置示意图,无法看到实验说明,加热装置已经省略.I.甲同学认为当D处盛放V2O5作催化剂时,此套装置可用于合...
- 硫酸亚铁晶体(FeSO4·7H2O)在医药上可作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下请回答下列问题:(1)步骤...
- Fe元素是地壳中最丰富的元素之一,在金属中仅次于铝,铁及其化合物在生活、生产中有广泛应用.请回答下列问题:(1)磁铁矿是...
- 为分析当地的空气质量状况,某校化学研究性学习小组的同学拟测定城市上空空气中SO2的含量并制定了下列研究方案:I.相关文献...
- 如图所示是用于气体制备、干燥、性质验证、尾气处理的部分仪器装置(加热及夹持固定装置均已略去,各装置可重复使用).请根...