本试题 “把以下左栏列举的金属的用途与右栏列举的有关金属的性质用线连起来。①金属可制成比纸还薄的金箔 a.导电性好②生活中用铁锅做饭 b.还原性强③用铁回收照相定影...” 主要考查您对单质铁
单质铜
金属晶体
合金
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 单质铁
- 单质铜
- 金属晶体
- 合金
铁元素:
在元素周期表中的位置:铁的原子序数26,位于周期表中第四周期,第Ⅷ族。
(1)物理性质:银白色、有金属光泽,密度较大,熔点较高,硬度较小,具有导电、导热、延展性,可被磁铁吸引。
(2)化学性质:较活泼的金属,+2、+3价两种价态
①与强氧化剂反应(如:Cl2 Br2 过量稀HNO3)生成+3价铁的化合物。如: 
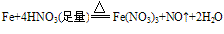
注:铁常温下在浓硫酸和浓硝酸中钝化,但加热可以反应,且被氧化成Fe3+
②与弱氧化剂反应(如S I2 H+ Cu2+)生成+2价铁的化合物,如: 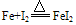
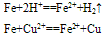
③铁与氧气、水蒸气反应生成Fe3O4(FeO·Fe2O3)

铁的性质:
- 物理性质:铁是黑色金属,具有铁磁性
- 铁的化学性质:
①与强氧化剂反应(如:Cl2、 Br2 、过量稀HNO3)生成+3价铁的化合物。如:
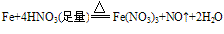
注:铁常温下在浓硫酸和浓硝酸中钝化,但加热可以反应,且被氧化成Fe3+
②与弱氧化剂反应(如S、 I2 、H+ 、Cu2+)生成+2价铁的化合物,如: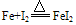
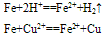
③铁与氧气、水蒸气反应生成Fe3O4(FeO·Fe2O3)

铁与稀硝酸的反应:
- 铁少量时:
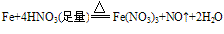
- 铁过量时:3Fe+8HNO3==3Fe(NO3)2+2NO+4H2O
两式可通过2Fe3++Fe==3Fe2+联系起来。
注意:
- 铁元素性质活泼,自然界中的铁元素几乎都是以化合态存在,只有在陨石中存在游离态的铁元素。
- 过量的铁与氯气反应,不会生成FeCl2,因为铁还原三价铁必须在水溶液中进行。
- 金属与强氧化性酸反应,不会生成H2。
化学性质:
铁元素性质活泼,有较强的还原性。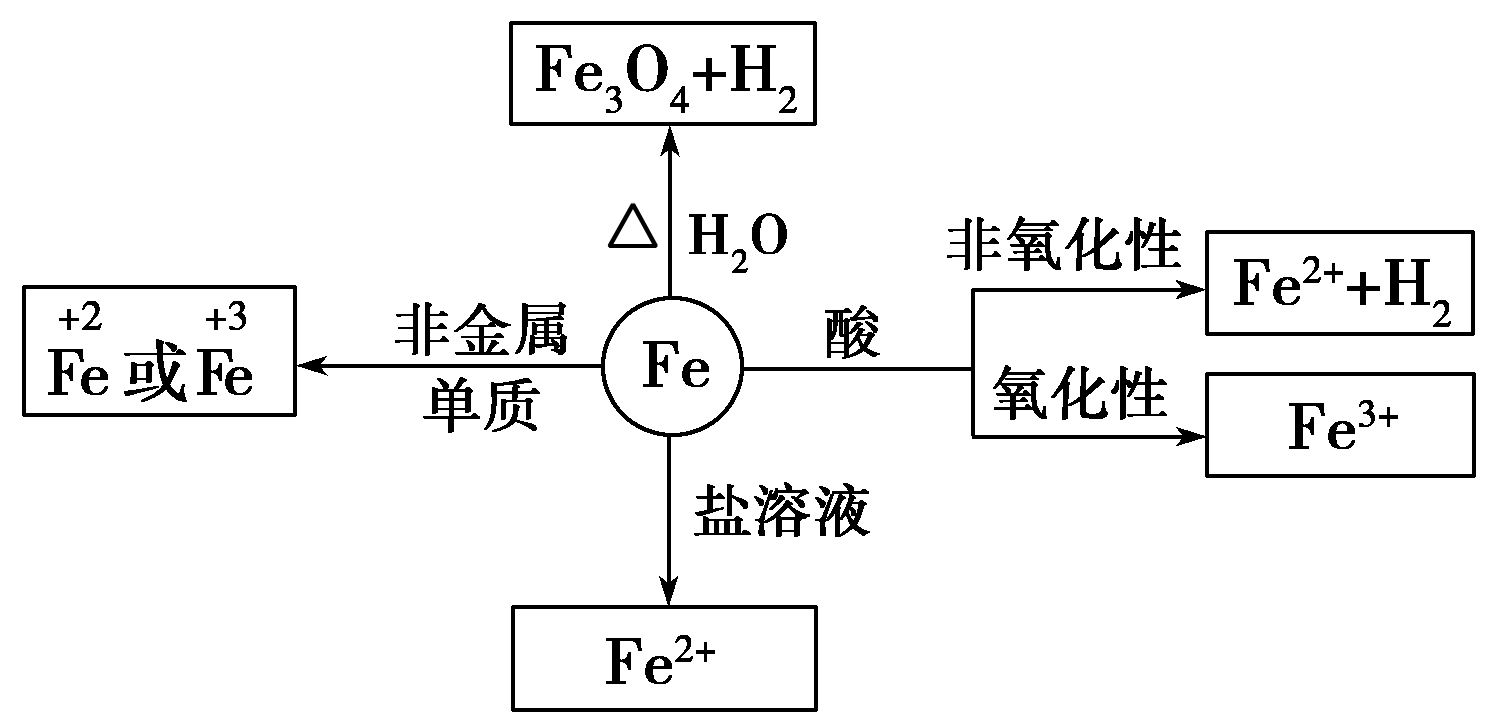
铁三角关系:

铜元素:
在元素周期表中的位置:铜的原子序数29,位于周期表中第四周期,第IB族。
(1)物理性质:有金属光泽,紫红色固体,密度较大,导电导热性能很好,具有很好的延展性,铜属于重金属、有色金属、常见金属,不能被磁铁吸引。
(2)化学性质: 铜常见的化合价为+1价和+2价
①在加热条件下,铜可与多种非金属单质反应。一般来说,遇到氧化性较弱的非金属,铜显较低化合价;遇到氧化性较强的非金属,铜显较高化合价。例如:与强氧化剂反应(如Cl2 Br2等)生成+2价铜的化合物。如:
Cu+Cl2 CuCl2 2Cu+O2
CuCl2 2Cu+O2 2CuO
2CuO
②铜与酸反应:铜只能被氧化性酸中的中心元素氧化。例如: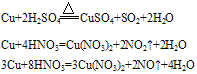
③铜与盐溶液反应:
Cu+2AgCl CuCl2+2Ag
CuCl2+2Ag
铜与铁的对比:
从金属活性顺序表:K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au可知,金属铁的金属活性比铜强,所以单质Fe可以从Cu的溶液中还原出单质来,例如: Fe+CuCl2 FeCl2+Cu
FeCl2+Cu
即Fe的还原性强于Cu
铜与浓硫酸和稀硫酸的反应:
Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
2Cu+O2+2H2SO4(稀) 2CuSO4+2H2O
2CuSO4+2H2O
注意:从金属活性顺序表:K Ca Na Mg Al Zn Fe Sn Pb (H)Cu Hg Ag Pt Au 可知,铜不能与稀硫酸发生反应,但是在有氧气和加热的条件下可以反应
铜与铜的化合物之间的转换图: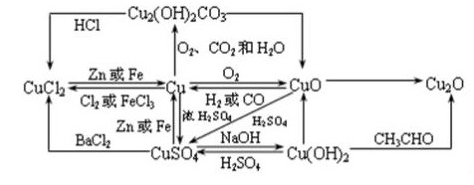
铜的制备和精炼:
(1)工业炼铜法:CuO+CO Cu+CO2
Cu+CO2
(2)湿法炼铜:Fe+CuSO4 FeSO4+Cu
FeSO4+Cu
(3)高温炼铜:工业上用高温冶炼黄铜矿的方法获得铜(粗铜):
2CuFeS2+4O2 Cu2S+3SO2+2FeO(炉渣)
Cu2S+3SO2+2FeO(炉渣)
2Cu2S+3O2 2Cu2O+2SO2
2Cu2O+2SO2
2Cu2O+Cu2S 6Cu+SO2↑
6Cu+SO2↑
备注:粗铜中铜的的含量为99.5%-99.7%,主要含有Ag、Zn、Au等杂质,粗铜通过电解精炼可得到纯度达99.95%-99.98%的铜,原理为用粗铜作阳极,失去电子变为Cu2+,用纯铜棒作阴极即可得精铜。
通过金属离子与自由电子间的较强作用(金属键)形成的单质晶体,熔沸点(除Hg外)高,导热性、延展性良好,易导电,硬度一般较大。
如:金属单质金属晶体原子堆积模型:
(1)简单立方堆积 (2)体心立方堆积 (3)六方最密堆积和面心立方最密堆积
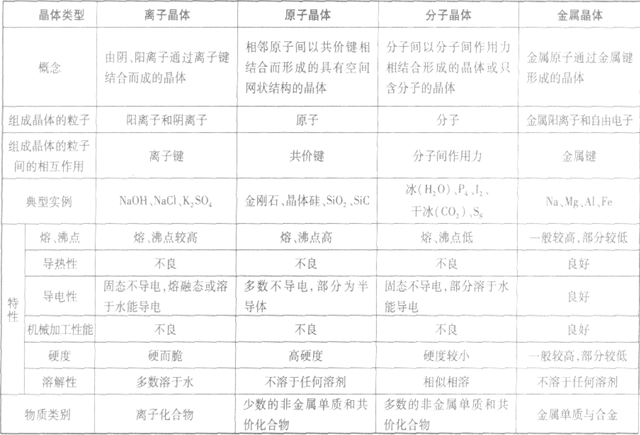
晶体的基本类型与性质:
金属晶体的原子堆积模型:
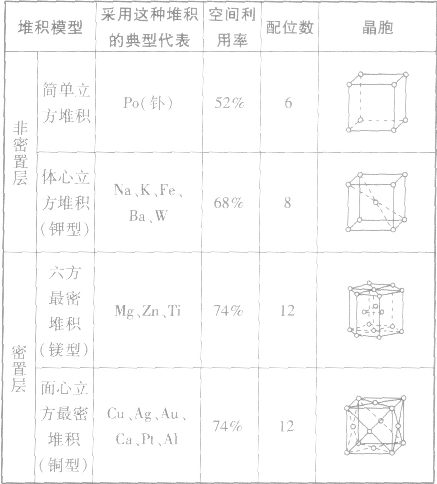
合金的概念:
由两种或两种以上的金属(或金属与非金属)熔合而成的具有金属特性的物质。
合金的特性:
合金与各成分金属相比,具有许多优良的物理、化学和机械性能。
(1)合金的硬度一般比它的成分金属的大。
(2)合金的熔点一般比它的成分金属的低。
钢:
(1)钢和生铁同属于铁的合金。将铁矿石冶炼成生铁,生铁进一步冶炼可成为钢。
(2)钢是用量最大、用途最广的合金,按其化学成分可分为两大类:碳素钢和合金钢。
(3)碳素钢俗称普通钢。根据含碳量的多少,碳素钢又可以分为三类,见下表:
| 合金名称 | 含碳 | 主要性质 |
| 低碳钢 | <0.3% | 韧性、焊接性好,但强度低 |
| 中碳钢 | 0.3%~0.6% | 强度高,韧性及加工性好 |
| 高碳钢 | >0.6% | 硬而脆,热处理后弹性好 |
| 名称 | 其他主要合金元素 | 主要特性 | 主要用途 |
| 锰钢 | 锰 | 韧性好,硬度大 | 钢轨、轴承、钢磨、挖掘机铲斗、坦克装甲 |
| 不锈钢 | 铬、镍 | 抗腐蚀性好 | 医疗器械、容器、炊具等 |
| 硅钢 | 硅 | 导磁性好 | 变压器、发电机和电动机的铁芯 |
| 钨钢 | 钨 | 耐高温,硬度大 | 刀具 |
其他几种常见合金的主要成分,性能和用途:
| 合金 | 主要成分 | 主要性能 | 主要用途 |
| 球墨铸铁 | 铁,碳,硅,锰 | 机械强度好 | 在某些场合可代替钢 |
| 黄铜 | 铜,锌 | 强度高、可塑性 好、易加工、耐腐蚀 |
机器零件、仪表、日用品 |
| 青铜 | 铜,锡 | 强度高、可塑性好、 耐磨、耐腐蚀 |
机器零件如轴承、齿轮等 |
| 白铜 | 镍,铜 | 光泽好、耐磨、 耐腐蚀、易加工 |
钱币、代替银做饰品 |
| 焊锡 | 锡,铅 | 熔点低 | 焊接金属 |
| 硬铝 | 铝,铜,锰,镁,硅 | 强度和硬度好 | 火箭、飞机、轮船等制造业 |
| 钛合金 | 钛,铝,钒 | 耐高温、耐腐蚀、高强度 | 用于宇航、飞机、造船,化学工业 |
| 金合金 | 金,银,铜,稀土元素 | 有光泽、易加工、耐磨、耐腐蚀、易导电 | 金饰品、电子元件、钱币、笔尖 |
| Ti-Fe合金 | Ti,Fe | 室温下吸收H2快,且吸收H2量大,稍稍加热放H2速率快 | 储氢合金 |
合金的分类:
(1)铝合金:常见的有镁铝合金、硬铝等。硬铝密度小,强度高,具有较强的抗腐蚀能力,是制造飞机和字宙飞船的理想材料。
(2)铜合金
(3)
(4)新型合金:钛合金、耐热合金和形状记忆合金等。
几种有色金属材料的比较及新型金属材料:
1.金,银,铜的重要物理性质,性能及应用比较
| 金 | 银 | 铜 | ||
| 物理性质 | 颜色 | 黄色 | 银白色 | 紫红色 |
| 硬度 | Au<Ag<Cu | |||
| 延展性 | Au>Ag>Cu | |||
| 导电性 | Ag>Cu>Au | |||
| 导热性 | Ag>Cu>Au | |||
| 性能 | 极高的抗腐蚀性 | 催化,抗腐蚀性 | 在潮湿空气中易锈蚀 | |
| 应用 | 电子工业,航空,航天工业 | 有机合成,能源开发,医用材料制造 | 电气和电子工业,建筑材料 | |
2.新型金属材料
(1)铀(U)用作核电站反应堆的核燃抖
(2)镅(Am)在烟雾探测器中用作烟雾监测材料
(3)钛(Ti)被誉为“21世纪的金属”,是一种“亲生物金属”
金属资源的合理开发和利用:
1.合理开采矿物地球上的金属矿产资源是有限的,而且是不可再生的。随着人类不断地开发利用,矿产资源日渐减少,节约并合理地开采矿产资源是合理利用金属资源最直接,最基本水的措施
2.防止金属腐蚀金属制品在使用过程中会因腐蚀而损坏,每年因腐蚀造成的钢铁资源损失占当年总产量的10%以上,因此防腐是避免金属资源损失、浪费的重要手段
3.回收和利用废旧金属回收的废旧金属制品,大部分可以重新制成金属或它们的化合物,再进行使用。例如废旧钢铁可以用于炼钢;废铁屑可用于制铁盐
4.寻找金属替代品随着金属资源的目益减少,利用可再生资源开发、研制出新型材料代替金属材料的应用,是当今社会的一项重要科研课题,例如已经研制出并已实际运用的高硬度、耐高温材料;新型的替代钢铁的无机非金属材料料;有机化工合成的各种强度的橡胶、塑料,复合材料等
与“把以下左栏列举的金属的用途与右栏列举的有关金属的性质用线...”考查相似的试题有:
- 铁和铁合金是生活中常见的材料,下列说法正确的是[ ]A.铁与盐酸反应,铁合金不与盐酸反应B.一定条件下,铁粉可与水蒸气反应...
- (7分)某学生设计了一个制取氢氧化亚铁的实验方案,实验装置见图,请分析实验过程:(1)在B试管中加入NaOH溶液后加热煮沸l-2...
- 下列变化不能通过一步实验直接完成的是[ ]A.Fe → Fe3O4B.Fe(OH)3→ Fe2O3C.Al → Al(OH)3D.Na2O2→ Na2CO3
- 农药波尔多液可用于水果灭虫,是由石灰水和硫酸铜溶液混合而成的悬浊液。它不能用铁制容器盛放,是因为铁与该农药中的硫酸铜...
- 金属材料在人类生产生活中有着重要的应用,但人们使用更多的不是纯金属,而是合金。(1)快中子反应堆的热交换剂用的是钠钾合...
- 类比是研究物质性质的常用方法之一,可预测许多物质的性质.但类比是相对的,不能违背客观事实.下列各种类比推测的说法中正...
- A-G及X、Y均是中学化学常见物质,其中B、D、E、F、G在常温下为气体且B为红棕色,C是红色的金属单质。它们之间有如下转化关系...
- 实验室常用下列装置来进行铜跟浓硫酸反应等一系列实验。(1)根据什么现象可判断铜跟浓硫酸反应有SO2生成 ___。根据什么现象可...
- 下列各组物质中,按熔点由低到高排列的是( )A.O2、I2、HgB.CO2、KCl、SiO2C.Na、K、RbD.NaCl、KCl、RbCl
- 合金具有许多优良的性能.下列物质属于合金的是( )A.钠B.硫C.青铜D.氧化铜