本试题 “能源是人类生存和发展的重要支柱。研究化学反应过程中的能量变化在能源紧缺的今天具有重要的理论意义。已知下列热化学方程式:① 2H2(g)+O2(g)=2H2O(l)H=-570...” 主要考查您对吸热反应、放热反应
盖斯定律
燃烧热
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 吸热反应、放热反应
- 盖斯定律
- 燃烧热
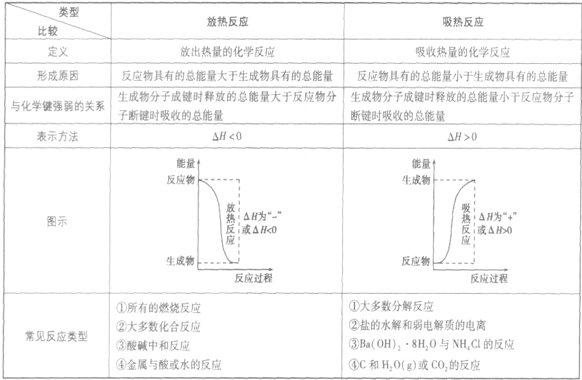
吸热反应:
吸收热量的反应,即生成物的总能量大于反应物的总能量,反应需要吸收能量
放热反应:
放出热量的反应,即生成物的总能量小于反应物的总能量,反应释放出能量
放热反应和吸热反应的比较:
吸收热量的反应,即生成物的总能量大于反应物的总能量,反应需要吸收能量
放热反应:
放出热量的反应,即生成物的总能量小于反应物的总能量,反应释放出能量
放热反应和吸热反应的比较:

盖斯定律的内容:
不管化学反应是一步完成还是分几步完成,其反应热是相同的。换句话说,化学反应的反应热只与反应的始态和终态有关,而与反应进行的途径无关。如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一一步完成时的反应热是相同的,这就是盖斯定律。
盖斯定律的意义:
利用盖斯定律可以间接计算某些不能直接测得的反应的反应热。例如: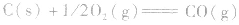 的△H无法直接测得,可以结合下面两个反应的△H,利用盖斯定律进行计算。
的△H无法直接测得,可以结合下面两个反应的△H,利用盖斯定律进行计算。
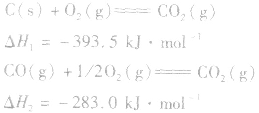
根据盖斯定律,就可以计算出所给反应的△H。分析上述两个反应的关系,即知
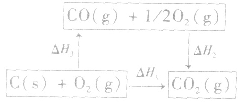
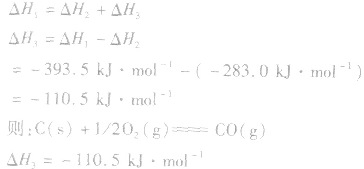
盖斯定律在反应热大小比较中的应用:
1.同一反应生成物状态不同时
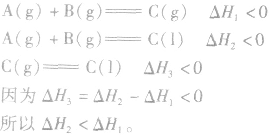
若按以下思路分析:
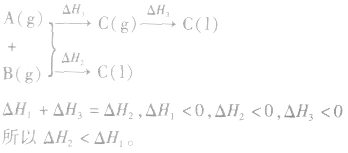
2.同一反应物状态不同时
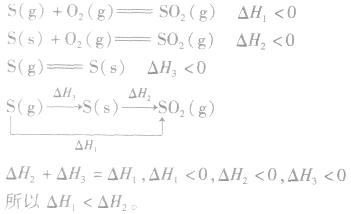
3.两个有联系的不同反应相比
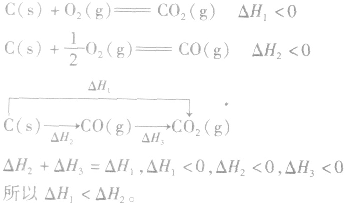
并且据此可写出下面的热化学方程式:

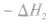
不管化学反应是一步完成还是分几步完成,其反应热是相同的。换句话说,化学反应的反应热只与反应的始态和终态有关,而与反应进行的途径无关。如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一一步完成时的反应热是相同的,这就是盖斯定律。
盖斯定律的意义:
利用盖斯定律可以间接计算某些不能直接测得的反应的反应热。例如:
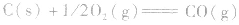 的△H无法直接测得,可以结合下面两个反应的△H,利用盖斯定律进行计算。
的△H无法直接测得,可以结合下面两个反应的△H,利用盖斯定律进行计算。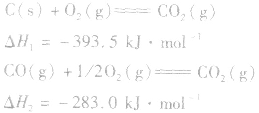
根据盖斯定律,就可以计算出所给反应的△H。分析上述两个反应的关系,即知
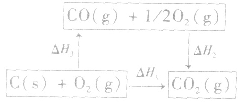
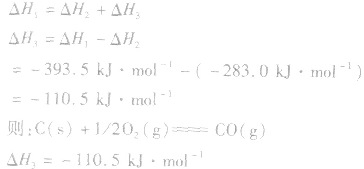
盖斯定律在反应热大小比较中的应用:
1.同一反应生成物状态不同时
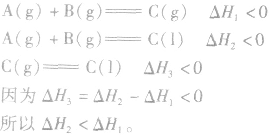
若按以下思路分析:
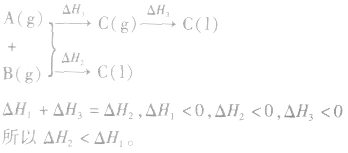
2.同一反应物状态不同时
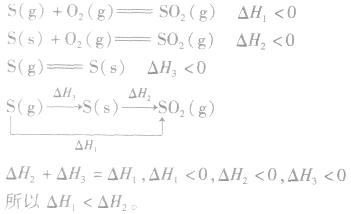
3.两个有联系的不同反应相比
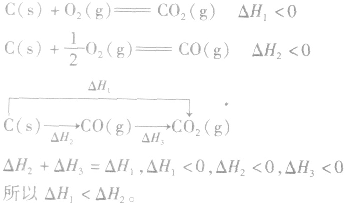
并且据此可写出下面的热化学方程式:

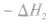
燃烧热:
在101kPa时,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热。单位为kJ/mol
注意事项:
(1)规定是在101kPa 下测出的热量。书中提供的燃烧热数据都是在25℃、101kPa下测定出来的
(2)规定可燃物的物质的量为1mol(这样才有可比性)。因此,表示可燃物的燃烧热的热化学方程式中,可燃物的化学计量数为1,其他物质的化学计量数常出现分数
(3)规定生成稳定的氧化物,例如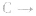
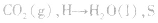
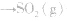 等
等
(4)叙述燃烧热时、不用“+”“-”,在热化学方程式中用△H表示时取“-”
在101kPa时,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热。单位为kJ/mol
燃烧热和中和热的异同:
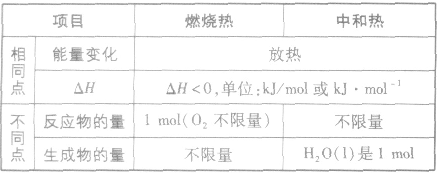
注意事项:
(1)规定是在101kPa 下测出的热量。书中提供的燃烧热数据都是在25℃、101kPa下测定出来的
(2)规定可燃物的物质的量为1mol(这样才有可比性)。因此,表示可燃物的燃烧热的热化学方程式中,可燃物的化学计量数为1,其他物质的化学计量数常出现分数
(3)规定生成稳定的氧化物,例如
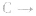
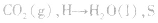
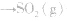 等
等 (4)叙述燃烧热时、不用“+”“-”,在热化学方程式中用△H表示时取“-”
发现相似题
与“能源是人类生存和发展的重要支柱。研究化学反应过程中的能量...”考查相似的试题有:
- 无论化学反应过程是一步完成还是分为数步完成,这个过程的热效应是相同的.已知:H2O(g)═H2O(l)△H1=-Q1kJ•mol-1①C2H5OH(...
- (1)用碳棒作电极,电解下列水溶液:①Na2SO4溶液 ②AgNO3溶液 ③KCl溶液 ④CuCl2溶液。通过相同电量时,阴极产生的气体物质的量...
- 下列说法中不正确的是A.煤、石油、天然气均为化石能源B.化石燃料在燃烧过程中能产生污染环境的SO2等有害气体C.直接燃烧煤...
- 丙烷在燃烧时能放出大量的热,它也是液化石油气的主要成分,作为能源应用于人们的日常生产和生活。已知:①2C3H8(g) +7O2(g) ...
- 强酸和强碱稀溶液的中和热可表示为:H+(aq)+OH-(aq)=H2O(l),△H=–57.3kJ·mol-1已知:CH3COOH(aq)+NaOH(aq)=CH3COONa(aq...
- “嫦娥一号”探月成功,实现了中国人“奔月”的梦想.(1)“嫦娥一号”使用的推进剂是液氢和液氧,这种推进剂的优点除产生的热量大之...
- 已知下列热化学方程式1/2CH4(g)+O2(g)=1/2CO2(g)+H2O(l) △H= -445.15kJ·mol-1CH4(g)+3/2O2(g)=CO(g)+2H2O(l) △H= -607.3kJ·mo...
- 下列热化学方程式中,△H能正确表示物质的燃烧热的是A.C(s) +1/2O2(g) ="=CO(g);" △H=-110.5 kJ/molB.CO(g) +1/2O2(g) ==CO...
- 硫酸盐主要来自地层矿物质,多以硫酸钙、硫酸镁的形态存在。(1)已知:①Na2SO4(s)=Na2S(s)+2O2(g) ; ΔH1=" +1011.0" kJ · m...
- 下面均是正丁烷与氧气反应的热化学方程式(25℃,101kPa):① C4H10(g)+13/2 O2(g)== 4CO2(g)+ 5H2O(l);△H=-2878KJ/m...