本试题 “实验室用2.0 mol/L NaCl溶液配制100mL 0.50 mol/L NaCl溶液。(1)配制上述溶液,需要2.0 mol/L NaCl溶液 mL。(2)配制上述溶液除需要玻璃棒、胶头滴管外,...” 主要考查您对物质的量
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 物质的量
物质的量:
物质中含有一定数目粒子集体的物理量。是国际单位制中7个基本物理量之一(7个基本的物理量分别为:长度、质量、时间、电流强度、发光强度、温度、物质的量)符号:n
计算公式:物质的量(n)=粒子数(N)/阿伏加德罗常数(NA) 以物质的量为中心的各种化学常用量间的关系:n=N/NA=m/M=V/Vm=cV=ρV/M
物质中含有一定数目粒子集体的物理量。是国际单位制中7个基本物理量之一(7个基本的物理量分别为:长度、质量、时间、电流强度、发光强度、温度、物质的量)符号:n
计算公式:物质的量(n)=粒子数(N)/阿伏加德罗常数(NA) 以物质的量为中心的各种化学常用量间的关系:n=N/NA=m/M=V/Vm=cV=ρV/M
使用物质的量注意事项:
(1)物质的量表示物质所含指定粒子的多少,物质的量是一个整体,不得简化或增添任何字。
(2)物质的量及其单位摩尔的适用范围是微观粒子,因此在使用中应指明粒子的名称。
物质的量的相关解法:
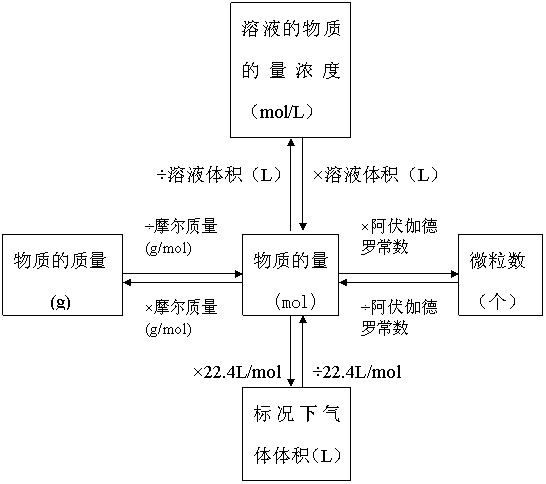
问题探究:
(1)1mol氢这种说法正确吗?如何表示1mol氢原子、1mol氢分子、1mol氢离子?
答:使用摩尔作单位时,应用化学式(符号)指明离子的种类,1mol氢的说法不正确,因其咩有指明是氢分子还是氢离子、氢原子。1mol氢原子、1mol氢分子、1mol氢离子分别表示为1molH、1molH2、1molH+。
(2)阿佛加德罗常数和6.02×1023mol-1在实际使用上有何区别?
阿佛加德罗常数是一个非常精确的数字,而6.02×1023mol-1只是阿佛加德罗常数的一个近似值。在关于概念性描述时要求非常准确,要使用阿佛加德罗常数,而在涉及计算时,则用6.02×1023mol-1进行粗略计算。二者关系类似于数学上的圆周率∏与3.14的关系。
发现相似题
与“实验室用2.0 mol/L NaCl溶液配制100mL 0.50 mol/L NaCl溶液。...”考查相似的试题有:
- 电解饱和食盐水,当阴极附近有0.8molNaOH生成时,导线中通过电子的物质的量是( )A.0.16molB.0.8 molC.0.4molD.0.2mol
- 设NA代表阿佛加德罗常数,下列说法错误的是( ) A.32g氧气所含的原子数目为NAB.0.5mol H2O含有的原子数目为 1.5 NAC.1 mol...
- (1)①48 g RO42-中,核外电子总数比质子总数多6.02×1023个,则R原子的摩尔质量为 。②有一真空瓶的质量为M1g,该瓶充入空气后...
- 设 NA为阿伏加德罗常数的数值,下列说法正确的是A.NA个CH4分子的质量为16g/molB.1mol/LNaCl溶液含有NA个Na+C.等物质的量的...
- 设NA为阿伏加德罗常数,下列说法不正确的是( )。A.1.5 mol NO2与足量的H2O反应,转移的电子数为NAB.常温常压下,0.5NA个CO2...
- 用98%的浓H2SO4(ρ=1.84 g·cm-3)配制1 mol·L-1的稀硫酸100 mL,按配制溶液时仪器的选用顺序排列,选择正确的是①玻璃棒 ②胶...
- (11分)Ⅰ、质量相等的O3和O2中,分子个数之比为___________,原子个数之比为____________; 如果是在相同温度和相同压强条件...
- 同温同压下,3体积A2气体跟1体积B2气体完全反应生成2体积C气体,则它的化学式是( ) A.A2BB.AB2C.BA3D.B3A
- 下列说法不正确的是[ ]A.1 mol 氧气中含有12.04×1023个氧原子,在标准状况下占有体积22.4 LB.1 mol臭氧和1.5 mol氧气含有相...
- 医院体检的血液化验单中,某患者葡萄糖为0.0079mol/L。表示该体检指标是A.物质的量(n)B.物质的量浓度(c)C.质量分数(w)D....