本试题 “(1)1mol H2O和1mol H2O2相比较,分子数之比为:_______________氧原子数之比为:_________________; 质量之比为:________________(3分)(2).实验室常用...” 主要考查您对物质的量
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 物质的量
物质的量:
物质中含有一定数目粒子集体的物理量。是国际单位制中7个基本物理量之一(7个基本的物理量分别为:长度、质量、时间、电流强度、发光强度、温度、物质的量)符号:n
计算公式:物质的量(n)=粒子数(N)/阿伏加德罗常数(NA) 以物质的量为中心的各种化学常用量间的关系:n=N/NA=m/M=V/Vm=cV=ρV/M
物质中含有一定数目粒子集体的物理量。是国际单位制中7个基本物理量之一(7个基本的物理量分别为:长度、质量、时间、电流强度、发光强度、温度、物质的量)符号:n
计算公式:物质的量(n)=粒子数(N)/阿伏加德罗常数(NA) 以物质的量为中心的各种化学常用量间的关系:n=N/NA=m/M=V/Vm=cV=ρV/M
使用物质的量注意事项:
(1)物质的量表示物质所含指定粒子的多少,物质的量是一个整体,不得简化或增添任何字。
(2)物质的量及其单位摩尔的适用范围是微观粒子,因此在使用中应指明粒子的名称。
物质的量的相关解法:
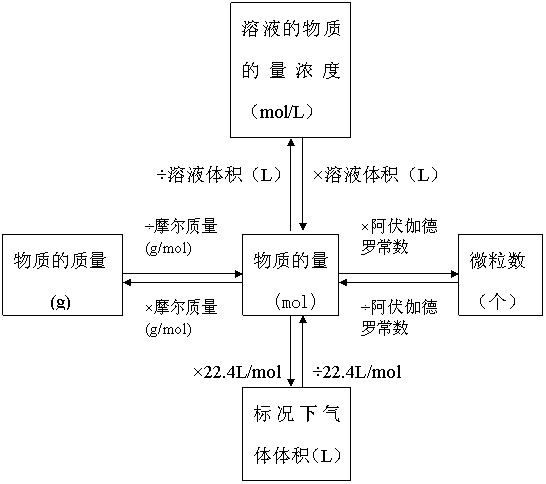
问题探究:
(1)1mol氢这种说法正确吗?如何表示1mol氢原子、1mol氢分子、1mol氢离子?
答:使用摩尔作单位时,应用化学式(符号)指明离子的种类,1mol氢的说法不正确,因其咩有指明是氢分子还是氢离子、氢原子。1mol氢原子、1mol氢分子、1mol氢离子分别表示为1molH、1molH2、1molH+。
(2)阿佛加德罗常数和6.02×1023mol-1在实际使用上有何区别?
阿佛加德罗常数是一个非常精确的数字,而6.02×1023mol-1只是阿佛加德罗常数的一个近似值。在关于概念性描述时要求非常准确,要使用阿佛加德罗常数,而在涉及计算时,则用6.02×1023mol-1进行粗略计算。二者关系类似于数学上的圆周率∏与3.14的关系。
发现相似题
与“(1)1mol H2O和1mol H2O2相比较,分子数之比为:___________...”考查相似的试题有:
- 设NA代表阿伏加德罗常数的值,下列说法不正确的是( )。A.阿伏加德罗常数NA是0.012kg12C中所含的原子数B.2g氢气所含氢原子数...
- 有多种金属组成的混合物粉末12 g与足量的稀盐酸反应,生成11.2 L(标况)H2,则该混合物可能由( )构成。A.Fe ZnAlB.ZnMg...
- 电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率的变化可以确定中和滴定的终点。某化学小组同学利用该原理在常...
- 下列有关阿佛加德罗常数(NA)的说法错误的是A.32克O2所含的原子数目为NA B.0.5molH2O含有的原子数目为1.5NAC.1molH2O含有的H2...
- (1)等物质的量的CO和CO2所含原子个数比为____________,质量比为____________。(2)含硫原子数相同的SO2和SO3的物质的量之...
- 每摩尔物质含有A.6.02×1023个分子B.6.02×1023个原子C.阿伏加德罗常数个原子D.阿伏加德罗常数个该物质的粒子
- 与1.8g H2O含有相同氧原子数的H2SO4为[ ]A.2.45gB.4.9gC.0.1gD.0.2g
- 把2.0mol/LCuSO4溶液和1.0mol/LH2SO4溶液等体积混合(假设混合后溶液的体积等于两溶液的体积之和)。(1)溶液中H+的物质的量...
- 设NA为阿伏加德罗常数的值。下列说法正确的是( )A.1 L 1 mol·L-1的NaClO 溶液中含有ClO-的数目为NAB.78 g苯含有C="C" 双...
- 所含分子数相同的一组物质是[ ]A、1gH2和1gN2B、1molH2O和1gH2OC、3.2gO2和4.8gO3D、44gCO2和16gO2