本试题 “下列叙述中不正确的是( )A.洁净的空气是纯净物B.石油和煤均属于混合物C.酒精和醋酸都是有机物D.缓慢氧化是放热反应” 主要考查您对爆炸、自燃
纯净物和混合物
有机化合物和无机化合物
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 爆炸、自燃
- 纯净物和混合物
- 有机化合物和无机化合物
自燃:
1. 概念:自燃是由缓慢氧化引起的自发燃烧。如果缓慢氧化产生的热量不能及时散失,就会越积越多,当温度升高到可燃物的着火点时,如果再遇到氧气就会引起自发的燃烧,这就是自燃。
爆炸:
1. 概念:通常说的爆炸指可燃物拒有限空间内急速燃烧,短时间内聚积大量的热量,使气体体积迅速膨胀引起的爆炸。
自燃:
露在地表的煤层,由于气候炎热,发生缓慢氧化反应而导致自燃。
贮存棉花、饲草的仓库,沾满机器油的破布、棉丝等堆积时间长了,通风不好有时就会自燃。在干燥的季节,森林也会自燃。
在坟地里出现“磷火”也是一种自燃现象。
人和动物机体里含磷的有机物腐败分解能生成磷化氢气体。这种气体着火点很低,接触空气就会自燃。在缺乏科学知识的时代,常把这种自燃现象说成是“鬼火”。
平时将白磷浸泡在冷水里,防止自燃。白磷的着火点低(40℃),可用它做自燃实验。取出少许白磷溶解在二硫化碳中,然后把溶液倒在滤纸上,待二硫化碳挥发后,白磷在滤纸上与空气中氧气充分接触就会自燃。
爆炸:
爆炸是我们日常生活中常见的观象,但有的爆炸仅仅是由物理变化引起的,如轮胎爆炸;有螳爆炸则是由化学变化引起的,如火药爆炸,汽油、液化气等燃料的爆炸等。其中,由化学变化引起的爆炸是学习的重点,这种类型的爆炸主要是由于:
①在有限的空间 (如炸弹)内,发生急速的燃烧,短时问聚积大量的热,使气体的体积迅速膨胀;
②氧气的浓度高,或者可燃物 (气体、粉尘)与氧气的接触面积很大,燃烧范围广,周围的空气迅速猛烈膨胀。防止这类爆炸的方法:通风,禁止烟火等。
燃烧,缓慢氧化,自燃,爆炸(由化学变化引起)的比较:
| 燃烧 | 缓慢氧化 | 自燃 | 爆炸 | |
| 概念 | 可燃物与氧气发生的一种发光放热的剧烈的氧化反应 | 缓慢进行的氧化反应 | 由缓慢氧化引起的自发燃烧 | 可燃物在有限空间内发生的急速燃烧 |
| 能量变化 | 放热明显 | 放出热量随时散失 | 放热明显 | 放热明显 |
| 温度 | 达到可燃物的着火点 | 未达到可燃物的着火点 | 达到可燃物的着火点 | 达到可燃物的着火点 |
| 是否发光 | 发光 | 无明显发光现象 | 发光 | 发光 |
| 联系 | 均属于氧化反应,均放出热量 | |||
易燃易爆物的安全知识:
(1)易燃物:一般来说,易燃物指的是那些易燃的气体和液体,容易燃烧、自燃或遇水可以燃烧的固体,以及一些可以引起其他物质燃烧的物质等。常见的有硫;磷、酒精,液化石油气、氢气、乙炔、沼气、石油产品、面粉、棉絮等。
(2)易爆物:指的是那受热或受到撞击时.容易发生爆炸的物质。
(3)一些与燃烧和爆炸有关的图标:

(4)再生产、运输、使用、储存易燃、易爆物时的注意事项:
①对厂房和仓库的要求:与周围建筑物间有足够的防火距离。车间,仓库要有防火、防爆、通风、静电除尘、消防等器材设备,严禁烟火,杜绝一切可能产生火花的因素。容器要求:要牢固、密封、警示标志明显且要注明物品名称、化学性质、注意事项。
③存放要求:单存、单放、远离火种:注意通风。
④运输要求:轻拿轻放、勿撞击。
⑤工作人员要求:严禁烟火、人走电断。
火灾自救及逃生策略:
(1)可燃性气体泄漏时的注意事项当室内天然气、液化石油气、煤气泄漏后室内充满可燃性气体.在此环境中打电话或打开换气扇开关,可能产生电火花,造成爆炸、所以应先关闭总阀、开窗通风,并在杜绝一切明火的同时,查找泄露的原因。
(2)火灾自救策略
①迅速找到安全通道;
②火灾时上层空气中氧气少,毒气浓度大,所以要匍匐前进:
③房间发生火灾时不能随时开门开窗,开门开窗会增加氧气量,使火势更加凶猛;
④火灾时,会产生大量浓烟,使人窒息,因此最好用湿布捂住口鼻;
⑤在山林中遇到火灾时,应逆风而跑,因为顺着风更容易被烧伤或发生危险。
爆炸极限:
(1)概念:可燃性气体在空气中达到一定浓度时,遇到明火会发生爆炸,人们把容易导致爆炸的空气中可燃性气体的体积分数范围,称为该气体的爆炸极限。
①当可燃性气体在混合气体中的含量高于爆炸极限的上限时,可燃性气体可以安静地燃烧;而低于爆炸极限的下限时,则无法燃烧。
②我们通常所说额可燃性气体检验纯度,其实就是检验可燃性气体有没有达到爆炸极限,只要超过爆炸极限的上限,可燃性气体就可以安静的燃烧。
(2)几种常见物质的爆炸极限
| 可燃物 | 爆炸极限 |
| 甲烷 | 5%-15% |
| 丙烷 | 2.2%-9.5% |
| 乙醇 | 3.4%-19% |
| 氢气 | 4.0%-75% |
| 一氧化碳 | 12.5%-74% |
| 液化气 | 2.0%-12% |
| 水煤气 | 7.0%-72% |
粉尘爆炸实验:
(1)实验装置及步骤
下面是模拟粉尘爆炸的一个实验:如下图所示,在无盖小塑料筒里放入干燥面粉,点燃蜡烛,用塑料盖盖住金属筒,迅速鼓入大量空气,不久,便会听到“砰”的一声,爆炸的气浪将金属筒的塑料盖掀起。
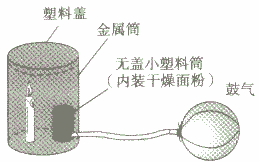
(2)现象:砰的一声响,伴随着一团火光产生,放热,塑料盖被掀起。
(3)分析:面粉被吹起,与空气充分接触,又被蜡烛点燃,在有限空间内发生急剧地燃烧,并让出大量热,产生的气浪将塑料盖掀起,说明可燃物的粉尘在有限的空间内急剧燃烧,能发生爆炸。
混合物:
(1)概念:由两种或多种物质混合而成的物质,没有有固定的组成,各成分保持自己原有的化学性质。
(3)常见的混合物:空气、合金、矿石、溶液等。
(4)混合物的提纯:混合物经过物理或化学的方法可以提纯。
纯净物:
(1)概念:只由一种物质组成的物质。
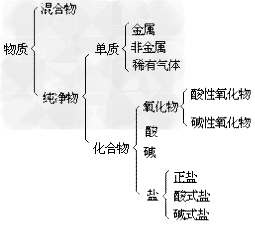
(3)纯净物的分类:纯净物根据物质组成的元素种类,分为两大类:单质和化合物。
纯净物和氧化物的区别:
| 纯净物 | 混合物 | |
| 概念 | 宏观:由一种物质组成的物质 微观:由同种分子构成(对于由分子构成的物质而言) |
宏观:由两种或多种物质组成的物质 微观:由不同种分子构成(对于由分子构成的物质而言) |
| 区别 | 由同种物质组成(对于由分子构成的物质,是由同种分子构成的),组成是固定的 | 由不同种物质组成(对于由分子构成的物质. 是由不同种分子构成的),组成是不固定的 |
| 特点 | ①具有固定的组成 ②具有一定的性质 ③有专门的化学符号 |
①没有固定的组成和性质 ②各成分保持各自的性质 ③没有专门的化学符号 |
| 分离方法 | 组成固定,不需分离;若需将化合物分成几种单质,则必须通过化学方法才能实现 | 物理方法: 筛选 过滤 蒸馏 |
| 实例 | 氧气,二氧化碳,高锰酸钾 | 空气,粗盐,蔗糖水 |
| 联系 | 纯净物是相对而言的,自然界中绝对纯净的物质是不存在的,通常的纯净物是指含杂质很少的具有高纯度的物质。两者间的关系为 | |
对纯净物和混合物概念的理解:
(1)混合物概念:混合物可以看作是由几种纯净物混合而成的,混合物的形成过程中发生的是物理变化。由于混合物的组成一般不固定,所以往往不能用化学式表示。
(2)纯净物概念:纯净物只由一种物质组成,有固定的组成.可以用化学式表示。
常考的纯净物与混合物:
(1)混合物:石油、煤、天然气、洁净的空气、生理盐水、矿泉水、汽水、碘酒、白酒、双氧水、盐酸、合金等都是混合物。
(2)纯净物:水银、烧碱、纯碱、胆矾、液态氧、液态氮、蒸馏水(纯水)、干冰、冰水共存物、金刚石、石墨、生石灰、熟石灰、氯化钠、氧化铁等都是纯净物:
物质的分类示意图:
(1)概念:通常人们将含有碳元素的化合物称为有机化合物,简称有机物,如甲烷、乙醇、葡萄糖、淀粉等。
(2)组成和结构:有机物都含碳元素,多数含有氢元素,可能还含有氧、氮、氯、硫、磷等元素。有机物中碳原子不仅可以和H,O,Cl,,N等原子直接结合,而且碳原子之间也可以互相连接成链状或环状。原子的排列方式不同,形成有机物的结构就不同,所表现出来的性质也不同。
(3)特点:大多数有机化合物都难溶于水,易溶于有机溶剂,大多数有机化合物受热易分解,且容易燃烧,燃烧产物有CO2和水;绝大多数有机化合物不易导电、熔点低。
(4)分类:
①有机物小分子:相对分了质量较小,如乙醇,甲烷、葡萄糖等。
②有机高分子化合物:简称有机高分子,其相对分子质量比较大,从几万到几十万,甚至高达几百万或更高,如淀粉、蛋白质等。
无机化合物:
(1)概念:无机化合物简称无机物,通常指不含碳元素的化合物,但少数含碳元素的化合物,如CO,CO2, H2CO3,CaCO3等,不具有有机化合物的特点,归在无机化合物中。
(2)分类:无机化合物根据元素组成及在水中离解成的粒子特点分为氧化物、酸、碱,盐。
氧化物,酸,碱,盐的比较:
| 物质类别 | 概念 | 分类 |
| 氧化物 | 由两种元素组成,期中一种是氧元素 | 金属氧化物:由金属元素与氧元素组成,如MgO,Fe2O3等 非金属氧化物:由非金属元素与氧元素组成,如CO2、SO2、H2O等 |
| 酸 | 能离解成氢离子和酸根离子的化合物 | 含氧酸:如H2SO4、H2CO3、HNO3等无氧酸:如HCl,H2S等 |
| 碱 | 由金属离子和氢氧根离子构成的化合物 | 可溶性碱:如NaOH,Ca(OH)2等不溶性碱:如Mg(OH)2、 Fe(OH)3等 |
| 盐 | 由金属离子(或铵根离子)和酸根离子构成的化合物 | 正盐:如NaCl、NH4Cl、Na2CO3,仅由金属离子或钱根离子和酸根离子两部分组成酸式盐:如NaHCO3、NH4HCO3,由金属离子或铵根离子、酸式酸根离子构成碱式盐;如Cu2(OH)2CO3,由金属离子、酸根离子和氢氧根离子构成 |
有机化合物与无机化合物的主要区别:
| 有机化合物 | 无机化合物 | |
| 溶解性 | 多数不溶于水。易溶于有机溶剂 | 有些溶于水而不溶于有机溶剂 |
| 耐热性 | 多数不耐热。熔点较低,一般在400℃ 以下 | 多数耐热,难熔化,熔点一般比较高 |
| 可燃性 | 多数可以燃烧 | 多数不能燃烧 |
概念的理解:
像NaCl、H2SO4和NaOH等不含碳元素的化合物称为无机化合物,而少数含碳元素的化合物,如CO,CO2和CaCO3等虽然含有碳元素,但具有无机化合物的特点,也把它们看作无机化合物。有机物一定含有碳元素,但含有碳元素的化合物不一定是有机物。含有碳元素但不属于有机物的化合物主要包括: 碳的氧化物、碳酸、碳酸盐和碳酸氢盐。
与“下列叙述中不正确的是( )A.洁净的空气是纯净物B.石油和煤...”考查相似的试题有:
- (4分) 某化学小组围绕燃烧与灭火的主题开展了相关活动。请你参与完成:(1)从图一中观察到的现象及所得到结论正确的是 。A.实...
- 某同学对所学的部分化学知识归纳如下:其中完全正确的一组是( )物质的性质与用途能源与环境A氢气、氧气有可燃性--作燃料一...
- 在农村人们常常饮用河水,河水中常含有大量的泥沙、悬浮物和细菌等杂质,一般可用次氯酸杀死细菌.将漂白粉(主要成分是次氯...
- 现有①水;②铁粉;③高锰酸钾;④井水;⑤二氧化锰五种物质。其中属于混合物的有_________(填序号,下同) ;属于纯净物的有____...
- 下列物质中,属于氧化物的是A.石灰水B.空气C.生铁D.干冰
- 水是生命之源.下列有关水的叙述中,错误的是( )A.自然界中的水都是混合物B.水中的色素和异味可以用活性炭除去C.用肥皂...
- 下列物质中属于有机物的是A.纯碱B.干冰C.小苏打D.酒精
- 一种“环保石头纸”在2010年的两会上以便签、文件袋等形式首次亮相.“环保石头纸”的主要原料是碳酸钙和高分子材料.“环保石头纸...
- 下列物质属于纯净物的是____;属于单质的是____;属于化合物的是____ ;属于混合物的是______。(填编号)①洁净的空气②二氧化...
- 下列物质中不属于有机物的是( )A.C2H5OHB.Na2CO3C.CH4D.CH3COOH