本试题 “KMnO4溶液与H2C2O4溶液可发生如下反2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O(1)、该反应速率开始十分缓慢,一段时间后突然加快,这是因为______(...” 主要考查您对酸碱中和滴定
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 酸碱中和滴定
酸碱中和滴定:
用已知物质的量浓度的酸(或碱)来测 定未知物质的量浓度的碱(或酸)的方法叫做酸碱中和滴定。
(1)原理:对于一元酸和一元碱发生的中和反应,C酸V酸=C碱V碱 或:C未知V未知=C标准V标准,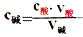
(2)仪器:a.酸式滴定管 b.碱式滴定管c.铁架台d.滴定管夹e.锥形瓶 f.烧杯g.胶头滴管等
(3)装置图: 
(4)操作步骤:
洗涤、检漏、水洗、润洗、装液、去泡、调液面记录、放待测液、加指示剂、滴定、记录、
计算、误差分析
(5)数据处理依据:
c(NaOH)=c(HCl)V(HCl)/V(NaOH)
(6)误差分析:
①仪器润洗不当:
a.盛标准液的滴定管用蒸馏水洗后未用标准液润洗;
b.盛待测液滴定(移液)管用蒸馏水洗后未用待测液润洗;
c.锥形瓶用蒸馏水洗后再用待测液润洗;
②读数方法有误:
a.滴定前仰视,滴定后俯视;
b.滴定前俯视,滴定后仰视;
c.天平或量筒的使用读数方法错误;
③操作出现问题:
a.盛标准液的滴定管漏液;
b.盛待测液的滴定管滴前尖嘴部分有气泡,终了无气泡
(或前无后有);
c.振荡锥形瓶时,不小心有待测液溅出;
d.滴定过程中,将标准液滴到锥形瓶外;
中和滴定中的误差分析:
中和滴定是一个要求较高的定量实验,每一个不当的或错误的操作都会引起误差。
对于一元酸与一元碱,由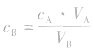 可知,
可知,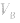 是准 确量取的体积,
是准 确量取的体积, 是标准溶液的浓度,它们均为定值,所以
是标准溶液的浓度,它们均为定值,所以 的大小取决于
的大小取决于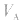 的大小,
的大小,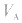 大则
大则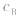 大,
大,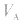 小则
小则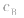 小。
小。
以标准酸溶液滴定末知浓度的碱溶液(酚酞作指示剂)为例,常见的不正确操作对实验结果的影响见下表: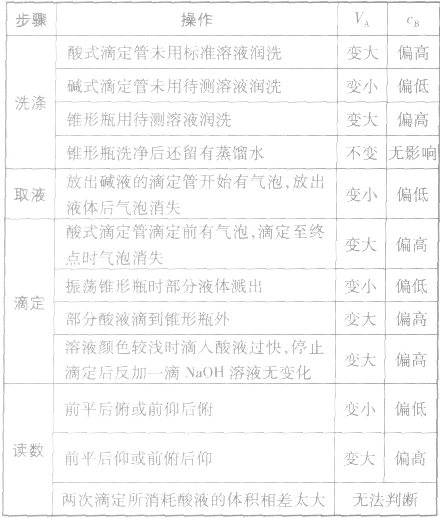
中和滴定应注意的问题:
1.中和滴定中指示剂的使用与选择
(1)用量不能太多,常用2~3滴,冈指示剂本身也是有机弱酸或有机弱碱,若用量太多,会使中和滴定中需要的酸或碱的量增多或减少。
(2)指示剂的选择:中和滴定时一般选用的指示剂有酚酞和甲基橙。石蕊试液由于颜色变化不明显,不易辨别,在滴定过程中不宜使用。
(3)酸、碱恰好完全反应时,终点溶液的pH应在指示剂的变色范围内,如强酸溶液滴定弱碱溶液应选用甲基橙作指示剂;强碱溶液滴定弱酸溶液应选用酚酞作指示剂。
(4)指示剂的变色:最好由浅到深,这样对比明显。如用强碱滴定强酸用酚酞作指示剂较好,当酚酞从无色变为粉红色(或浅红色)且半分钟内不褪色时即达到滴定终点。
2.欲减小实验误差的三点做法
(1)半分钟:振荡,半分钟内颜色不褪去,即为滴定终点。
(2)l一2min:滴定停止后,必须等待l~2min,让附着在滴定管内壁的溶液流下后,再进行读数。
(3)重复:同一实验,要做两到三次,两次滴定所用标准溶液的体积的差值不能超过0.02mL,再取平均值。
与“KMnO4溶液与H2C2O4溶液可发生如下反2KMnO4+5H2C2O4+3H2SO4=K2...”考查相似的试题有:
- 人体血液里Ca2+离子的浓度一般采用mg/mL来表示.加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙...
- 下列实验误差分析错误的是( )A.用润湿的pH试纸测稀碱溶液的pH,测定值偏小B.用容量瓶配制溶液,定容时俯视刻度线,所配溶...
- 某烧碱样品含有少量不与酸作用的杂质,为了测定其纯度,进行以下两步操作:第一步:配制500ml 烧碱样品溶液.(1)检查容量瓶...
- 当用碱滴定酸时,下列操作中可能使测定结果(酸的浓度)偏低的是( )A.滴定后读取标准液体积时仰视B.锥形瓶用蒸馏水洗后,...
- 某学生欲用已知物质的量浓度的盐酸来滴定测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:(1)下...
- (1)化学是一门以实验为基础的学科,化学实验是化学学习的重要内容.根据你掌握的知识判断,下列实验操作的描述中,正确的是...
- 某学习小组的学生用标准浓度的氢氧化钠溶液测定未知浓度的盐酸溶液,(1)该学生盛装标准液的仪器和指示剂选用正确的一组是__...
- 用酸式滴定管准确移取25.00mL某未知浓度的盐酸于一洁净的锥形瓶中,然后用0.20mol•L-1的氢氧化钠溶液(指示剂为酚酞).滴定...
- 如图所示,向10 mL一定物质的量浓度的盐酸X中逐滴加入一定物质的量浓度的NaOH溶液Y,依据图象推出X和Y的物质的量浓度是下表内...
- 下列说法正确的是[ ]A.苯酚沾在手上,直接用NaOH溶液洗B.把NH4Cl溶液滴在干燥的pH试纸上,测得pH=9C.验证溴乙烷消去反应...