本试题 “下列关于化学观或化学研究方法的叙述中,错误的是[ ]A.在化工生产中应遵循“绿色化学”的思想B.在元素周期表的过渡元素中寻找优良的催化剂C.汽车尾气中产生N...” 主要考查您对元素周期表
元素周期律
绿色化学
大气污染、改善大气质量
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 元素周期表
- 元素周期律
- 绿色化学
- 大气污染、改善大气质量
元素周期表编排原则:
(1)把电子层数相同的各种元素按原子序数递增的顺序从左至右排成横行。
(2)把最外层电子数相同的元素按电子层数递增的顺序由上到下排列成纵行。
注意:①元素周期表是元素周期律的具体表现形式,它反映了元素之间相互联系的规律。
②历史上第一个元素周期表是1869年俄国化学家门捷列夫在前人探索的基础上排成的,他将元素按相对原子质量由小到大依次排列,并将化学性质相似的元素放在一个纵行。
元素周期表的结构:
(1)周期
①周期的含义在元素周期表中,把电子层数相同的元素,按原子序数递增的顺序从左到右排成横行,这样每个横行为一个周期。现在使用的元素周期表有7个横行,即7 个周期。
②周期的划分
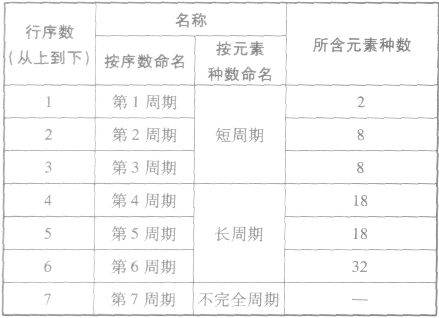
(2)族
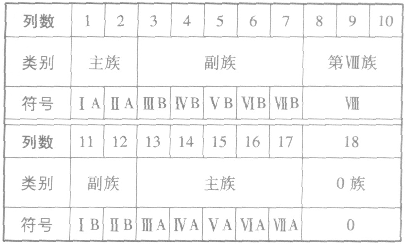
①族的含义在周期表中,把不同横行(即周期)中最外层电子数相同的元素,按电子层数递增的顺序由上到下排成纵行,除第8、9、10三个纵行叫做第Ⅷ族外,其余15个纵行,每个纵行为一族。现在使用的元素周期表有18 个纵行,它们被划分为16个族。
②族的划分
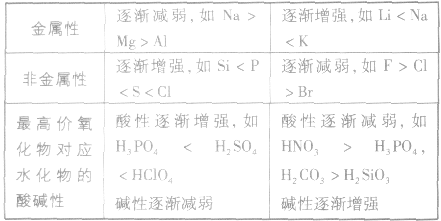
(3)元素周期表中主族元素金属性和非金属性的递变
定义:
元素的性质随原子序数的递增而呈现周期性变化的规律叫元素周期律。
实质:
元素性质随原子序数递增呈现周期性变化是元素原子的核外电子排布周期性变化的必然结果。
元素周期表中主族元素性质递变规律:

金属性强弱的判断依据:
1.单质跟水或酸反应置换出氢的难易程度(或反应的剧烈程度):反应越容易,说明其金属性越强。
2.最高价氧化物对应水化物的碱性强弱:碱性越强,说明其金属性越强,反之则越弱。
3.金属间的置换反应:依据氧化还原反应的规律,金属甲能从金属乙的盐溶液里置换出乙,说明甲的金属性比乙强。
4.金属活动性顺序按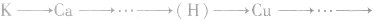 Au顺序,金属性逐渐减弱。
Au顺序,金属性逐渐减弱。
5.元素周期表中,同周期元素从左至右金属性逐渐减弱;同主族元素从上至下金属性逐渐增强。
6.原电池中的正负极:一般情况下,活泼金属作负极。
7.金属阳离子氧化性的强弱:阳离子的氧化性越强.对应金属的金属性就越弱。
非金属性强弱的判断依据:
1.同周期元素,从左到右,随核电荷数的增加,非金属性增强;同主族元素,从上到下,随着陔电荷数的增加,非金属性减弱。
2.最高价氧化物对应水化物的酸性强弱:酸性越强,其元素的非金属性也越强,反之则越弱。
3.气态氢化物的稳定性:稳定性越强,非金属性越强。
4.单质跟氢气化合的难易程度:越易与H2反应,说明其非金属性越强。
5.与盐溶液之间的置换反应:非金属元素甲的单质能从非金属乙的盐溶液中置换出乙,说明甲的非金属性比乙强。如 ,说明溴的非金属性比碘强。
,说明溴的非金属性比碘强。
6.相互化合后的价态:如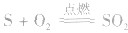 ,说明O 的非金属性强于S。
,说明O 的非金属性强于S。
7.其他:如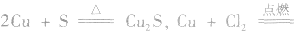 CuCl2,所以C1的非金属性强于S。
CuCl2,所以C1的非金属性强于S。
微粒半径大小的比较方法:
1.同周期元素的微粒
同周期元素的原子或最高价阳离子半径随核电荷数增大而减小(稀有气体元素除外),如半径:Na>Mg >Al,Na+>Mg2+‘>Al3+。
2.同主族元素的微粒
同主族元素的原子或离子半径随核电荷数增大而增大,如半径: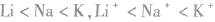
3.电子层结构相同的微粒电子层结构相同(核外电子排布相同)的微粒半径随核电荷数的增加而减小,如半径: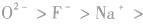
 (上一周期元素形成的阴离子与下一周期元素形成的最高价阳离子有此规律)。
(上一周期元素形成的阴离子与下一周期元素形成的最高价阳离子有此规律)。
4.同种元素形成的微粒同种元素原子形成的微粒半径大小为:阳离子< 中性原子<阴离子;价态越高的微粒半径越小,如半径: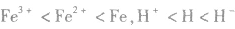 。
。
5.核外电子数和核电荷数都不同的微粒可通过一种参照物进行比较,如比较 的半径大小,可找出与A13+电子数相同,与S同主族的氧元素的阴离子
的半径大小,可找出与A13+电子数相同,与S同主族的氧元素的阴离子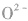 进行比较,半径:
进行比较,半径: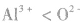 ,且
,且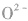
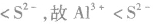
元素周期表中的几项重要规律相等规律:
| 规律 | 内容 |
| 相等规律 | ①周期数:电子层数 ②主族元素原子的最外层电子数=价电子数=主族序数=最高正化合价(F、 0除外) ③最低负价绝对值=8一主族序数(限 ⅣA族~ⅦA族非金属元素) |
| “位、构、性”规律 | |
| 递变规律 | 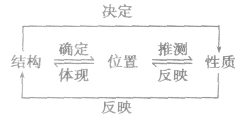 |
| 同周期从左到右,元素的金属性逐渐减弱,非金属性逐渐增强同主族从上到下,元素的金属性逐渐增强,非金属性逐渐减弱 | |
| 奇偶规律 | 在同一主族内,族序数和原子序数、核内质子数、核电荷数、核外电子数、最外层电子数(价电子数)、离子的电荷数、元素的主要正负化合价数等,若一个是偶数,其他的都是偶数,若一个是奇数,其他的都是奇数 |
| 相同电子层结构的规律 | 稀有气体元素的原子与同周期非金属元素的阴离子以及下一周期主族金属元素的阳离子具有相同的电子层结构 |
| 序差规律 | ①同主族相邻元素的原子序数之差与主族序数有关。IA~ⅡA族元素相差原子序数较小的元素所在周期包含的元素种数。ⅢA族~O族元素相差原子序数较大的元素所在周期包含的元素种数。如Na和K的原子序数相差8 (第三周期含8种元素),Cl和Br的原子序数相差18(第四周期含18种元素) ②同周期主族元素(长周期)的原子序数差:两元素分布在过渡元素同侧时,原子序数差=族序数差;两元素分布在过渡元素两侧时,第四或第五周期元素原子序数差=族序数差+10(如第四周期的Ca和Ca相差11),第六、七周期元素原子序数差=族序数差+24(如ⅡA 族的Ba和ⅢA族的Tl相差25) |
| 对角线相似规律 | 周期表中位于对角线位置的元素性质相似,尤以“和Mg、Be和Al最为典型 |
1.定义绿色化学是一门研究运用现代科学技术的原理和方法来减少或消除化学产品的设计、生产和应用中有害物质的使用与产生,使所研究开发的化学产品和过程对环境更加友好的学科。
2.绿色化学的基本原则
(1)防治污染的产生优于治理产生的污染;
(2)原子经济性(设计的合成方法应将反应过程中所用的材料,尽可能全部转化到最终产品中)即原子的利用率达到100%。
(3)应考虑到能源消耗对环境和经济的影响,并应尽量少地使用能源(在常温、常压下进行)。
(1)大气污染源:颗粒物、硫的氧化物、氮的氧化物、CO 碳氢化合物、氟氯代烷
(2)大气污染危害:危害人体健康、影响动植物的生长、严重时会影响地球的气候
(3)全球性三大环境问题:酸雨、臭氧层受损、温室效应
①酸雨:正常雨水:PH约为5.6 酸雨:PH小于5.6 我国为硫酸型酸雨,烧煤炭造成
硫酸型:硫的氧化物转化 SO2+H2O=H2SO3 2H2SO3+O2=2H2SO4 大气中烟尘和O3作催化剂
硝酸型:氮的氧化物转化 3NO2+H2O=2HNO3+NO↑
②臭氧层:自然界的臭氧90%集中在距地面15-50km的大气平流层中 吸收自太阳的大部分紫外线
引起臭氧层受损物质 氟氯代烷(致冷剂)、哈龙(含溴的灭火剂)、CCl4、N2O、NO、核弹爆炸产物
保护臭氧层公约:《保护臭氧层维也纳公约》 《关于消耗臭氧层物质的蒙特利尔议定书公约》
③温室效应:太阳短波辐射可以透过大气射入地面,而地面增暖后放出的长短辐射却被大气中的二氧化碳等物质所吸收,从而产生大气变暖的效应
温室效应后果:荒漠将扩大,土地侵蚀加重,森林退向极地,旱涝灾害严重,雨量将增加7-11%;温带冬天更湿,夏天更旱;热带也将变得更湿,干热的副热带变得更干旱,两极冰块将熔化,使海平面上升1米多,引起厄尔尼诺现象
引起温室效应的物质:CO2、CH4、N2O、氟氯代烷
改善大气质量:
①减少煤等化石燃料燃烧产生污染:改善燃煤质量、改进燃烧装置、技术和排烟设备、发展洁净煤技术和综合利用、调整和优化能源结构
煤的综合利用: 煤的的干馏、煤的气化、煤的液化
煤的气化 C+H2O(g)=CO+H2
煤的液化 CO+2H2→CH3OH
煤的脱硫 2CaCO3+O2+2SO2=2CaSO4+2CO2
②减少汽车等机动车尾气污染
尾气污染(占大气污染排出总量的40-50%):CO、NO2、NO、碳氢化合物
使用无铅汽油:四乙基铅作抗爆震剂,铅对神经系统损害大
尾气系统加催化转化器:前半部 2CO+2NO2
 CO2+N2 后半部 2CO+O2
CO2+N2 后半部 2CO+O2 2CO2 C7H16+11O2
2CO2 C7H16+11O2 7CO2+8H2O
7CO2+8H2O与“下列关于化学观或化学研究方法的叙述中,错误的是[ ]A.在化...”考查相似的试题有:
- (1)根据氢元素最高正价与最低负价的绝对值相等,有人提议可把氢元素放在周期表中的ⅣA族.那么根据NaH的存在,又可把氢元素...
- 已知A、B、C、D、E是短周期的五种元素,它们的原子序数依次增大。A元素原子形成的离子核外电子数为零;C、D、E三种元素的最高...
- (12分)X、Y、Z三种短周期元素,它们的原子序数之和为16。三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如图...
- 新华网达卡2010年8月6日电(记者粘轶锋)为了解决生活用水问题,孟加拉政府在国际援助机构帮助下在全国各地打了数百万口深层...
- A、B、C、D是元素周期表前三周期中的4种元素,A能与D组成AD2型化合物,AD2中核外电子总数是30,D-的核外电子排布与Al3+相同...
- A、B、C、D、E五种短周期元素的原子序数依次增大。元素A的负一价离子具有和稀有气体He一样的结构,元素B的最外层电子数是内层...
- 下列有关叙述:①非金属单质N能从M的化合物中置换出非金属单质M;②M原子比N原子容易得到电子;③两元素的阴离子在电极上放电时...
- 若aAn+与bB2-两种离子的核外电子层结构相同,则a等于A.b+n-2B.b+n+2C.b-n-2D.b-n+2
- 下列关于合成氨工业的叙述可用勒夏特列原理来解释的是 ( )。A.使用铁触媒,使平衡向生成NH3的方向移动B.高压比常压条件更有...
- 你认为减少酸雨产生的途径可采取的措施是 ( )。①少用煤作燃料 ②把工厂烟囱造高 ③燃料脱硫 ④在已酸化的土壤中加熟石灰 ⑤开...