本试题 “有A、B、C、D四种强电解质,它们在水中电离时可产生下列离子(每种物质只含有一种阴离子且互不重复)已知:①A、C溶液的pH均大于7,相同浓度的A、B的溶液中水...” 主要考查您对离子方程式
溶液的酸碱性
粒子浓度大小的比较
物质的鉴别
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 离子方程式
- 溶液的酸碱性
- 粒子浓度大小的比较
- 物质的鉴别
用实际参加反应的离子符号表示离子反应的式子。
离子方程式书写规则:
①写:写出化学反应方程式
②拆:把易溶于水、易电离的物质写成离子形式,难容难电离的物质及气体等仍用化学式表示
③删:删去方程式两边不参加反应的离子
④查:检查离子方程式两边各元素的原子个数和电荷总数是否相等
离子方程式书写及正误的判断方法:
①判断反应是否在水溶液中进行
因为电解质在水溶液中可以电离为自由移动的离子,在这种条件下才能发生离子反应。
②判断反应能否发生。
如果反应不能发生,当然也就没有离子方程式可言。
③判断反应物、生成物是否正确。
④判断质量和电荷是否守恒。
离子方程式不仅要质量守恒,而且反应前后各离子所带电荷总数必须相等。
⑤判断氧化物、难溶物、气体、单质、难电离的弱酸、弱碱、水是否写成了分子形式,而易电离的物质是否写成离子形式。
⑥判断连接符号“=”和“
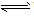 ”及状态符号“↑”和“↓”运用是否正确。
”及状态符号“↑”和“↓”运用是否正确。 强电解质的电离、不可逆反应、双水解反应用“=”;弱电解质电离、可逆反应、水解反应用“
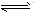 ”。复分解反应、水解反应生成的难溶物用“↓”,气体用“↑”;单水解反应生成的难溶物不用“↓”,气体不用“↑”。
”。复分解反应、水解反应生成的难溶物用“↓”,气体用“↑”;单水解反应生成的难溶物不用“↓”,气体不用“↑”。 ⑦判断微溶物的处理是否正确。
微溶物做反应物时,一般用离子形式,做生成物时一般用分子式。
⑧判断反应物的滴加顺序与方程式中生成物是否一致。
如:把碳酸钠溶液滴加到盐酸溶液中,和把盐酸滴加到碳酸钠溶液中反应产物是不同的。
⑨判断反应物的相对量与产物是否一致。
有些反应因反应物的量不同会生成不同的产物。如:CO2、SO2、H2S等气体与碱溶液反应时,若气体少量,则生成正盐;若气体过量,则生成酸式盐。
⑩判断电解质在写成离子形式时阴阳离子个数比是否合理。
如Ba(OH)2溶液和稀H2SO4反应的离子方程式往往错误写成:
 ,正确为:
,正确为: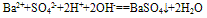
书写与量有关的离子方程式:
基本方法是:把物质的量少的物质的系数定为1,其他物质按最大量消耗。
1.因滴加顺序不同造成连续反应
- HCl与Na2CO3
向Na2CO3溶液中滴入盐酸溶液至过量,其离子反应分步写 (1)CO32-+H+==HCO3- (2)HCO3-+H+==CO2↑+H2O
若向盐酸溶液中滴入Na2CO3溶液至不再产生气体,其离子反应一步完成 CO32-+2H+==CO2↑+H2O
若向足量Na2CO3溶液中加入少量的盐酸溶液,其离子方程式为: CO32-+H+==HCO3-
- HCl与NaAlO2
向Na2CO3溶液中滴入盐酸溶液至过量,其离子反应分步写 (1)CO32-+H+==HCO3- (2)HCO3-+H+==CO2↑+H2O
若向盐酸溶液中滴入Na2CO3溶液至不再产生气体,其离子反应一步完成 CO32-+2H+==CO2↑+H2O
若向足量Na2CO3溶液中加入少量的盐酸溶液,其离子方程式为: CO32-+H+==HCO3-
- AlCl3与NaOH
向AlCl3溶液中滴入NaOH溶液至过量,其离子反应分步写 (1)Al3++3OH-==Al(OH)3↓ (2)Al(OH)3+OH-==AlO2-+2H2O
若向NaOH溶液中加入少量AlCl3溶液,其离子反应一步完成 Al3++4OH-==AlO2-+2H2O
若向足量Al2(SO4)3溶液中加入少量的NaOH溶液,其离子方程式为: Al3++3OH-==Al(OH)3↓
- AgNO3与NH3·H2O
向AgNO3溶液中滴入稀NH3·H2O至过量,其离子反应分步写(1) Ag++NH3·H2O==AgOH↓+NH4+ (2)AgOH+2NH3·H2O==Ag(NH3)2++OH-+2H2O
若向NH3·H2O溶液中加入少量AgNO3,其离子反应一步完成 Ag++3NH3·H2O==Ag(NH3)2++OH-+NH4++2H2O
若向足量AgNO3溶液中滴入少量NH3·H2O,其离子方程式为:Ag++NH3·H2O==AgOH↓+NH4+
- CO2与NaOH
向NaOH溶液中通人CO2气体至过量,其离子反应分步写 (1)2OH-+CO2==CO32-+H2O (2)CO32-+CO2+H2O==2HCO3-
若向足量NaOH溶液中通人少量CO2气体,其离子方程式为: 2OH-+CO2==CO32-+H2O
若向NaOH溶液中通人过量CO2气体,其离子反应一步完成 OH-+CO2==HCO3-
2.过量型:
向足量的Ca(HCO3)2溶液中逐渐滴入NaOH溶液 OH-+Ca2++HCO3-==H2O+CaCO3↓
向足量的NaOH溶液中逐渐滴入Ca(HCO3)2溶液 Ca2++2HCO3-+2OH-==2H2O+CaCO3↓+CO32-
Fe与HNO3 :铁过量时:Fe+4HNO3==Fe(NO3)3+NO↑+2H2O
铁不足时:3Fe+8HNO3==3Fe(NO3)2+2NO↑+4H2O
3.定量型:
因还原性I->Fe2+>Br-,所以在FeI2或者FeBr2中通入一定量的Cl2,发生不同的离子反应,依次为:
(1)2I-+Cl2==2Cl-+I2(2)2Fe2++Cl2==2Fe3++2Cl-(3)2Br-+Cl2==2Cl-+Br2
4.目标型
向明矾溶液逐滴滴加Ba(OH)2溶液至硫酸根离子刚好沉淀完全 Al3++SO42-+Ba2++4OH-==AlO2-+2BaSO4↓+2H2O
向明矾溶液逐滴滴加Ba(OH)2溶液至铝离子刚好沉淀完全 Al3+SO42-+Ba2++3OH-==Al(OH)3↓+2BaSO4↓
(1)pH=-lg[c(H+)],在溶液的c(H+)很小时,用pH来表示溶液的酸度。
(2)pH越大,c(H+)越小,c(OH-)越大,酸性越弱,碱性越强。pH越小,c(H+)越大,c(OH-)越小,酸性越强,碱性越弱。
(3)pH的范围:0~14
(4)溶液酸碱性判断:
当c(H+)>c(OH-)时,溶液呈酸性;
当c(H+)>=c(OH-)时,溶液呈键性;
当c(H+)<c(OH-)时,溶液呈中性。
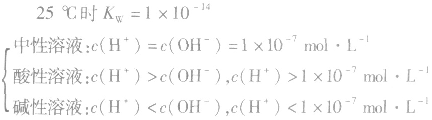
(5)关于pH相同的酸(含强酸和弱酸)
①溶液中c(H+)相等(填“相等”或“不等”)。
②溶液中溶质的物质的量的浓度:强酸<弱酸(填“>”或“<”)。
③耗碱规律:pH和溶液体积均相同的HCl、H2SO4、CH3COOH与碱完全反应时,消耗碱物质的量最多的是CH3COOH。
④稀释规律:分别加水稀释m倍时,溶液的物质的量的浓度均变为原来的1/m,强酸中c(H+)变为原来的1/m,但弱酸中c(H+)减小小于(填“大于”或“小于”)m倍,故稀释后弱酸酸性强于强酸。
溶液的pH:
1.定义:溶液里H+的物质的量浓度的负对数叫做pH。
2.表达式:
3.含义: pH越大,c(H+)越小,c(O-一)越大,酸性越弱,碱性越强。pH越小,c(H+)越大,c(OH-)越小,酸性越强,碱性越弱。
4.适用范围:
c(H+)很小时,用pH来表示溶液的酸碱度更方便。所以,pH适用于酸、碱的稀溶液
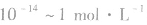 之间],pH取值范刚为0~14。
之间],pH取值范刚为0~14。
5.溶液的酸碱性和pH: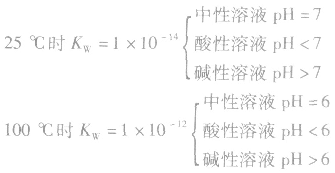
离子浓度大小比较方法:
(1)考虑水解因素:如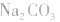 溶液
溶液 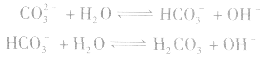
所以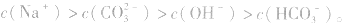
(2)不同溶液中同一离子浓度的比较要看溶液中其他离子对它的影响。如相同浓度的
 三种溶液中,
三种溶液中, 由大到小的顺序是c>a>b。
由大到小的顺序是c>a>b。
(3)混合液中各离子浓度的比较要综合分析水解因素、电离因素。如相同浓度的 的混合液中,离子浓度顺序为:
的混合液中,离子浓度顺序为: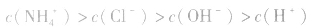
 的电离程度大于
的电离程度大于 的水解程度。
的水解程度。
盐溶液的“三大守恒”:
①电荷守恒:电解质溶液中所有阳离子所带有的正电荷数与所有的阴离子所带的负电荷数相等。如NaHCO3溶液中:
推出: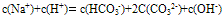
②物料守恒:电解质溶液中由于电离或水解因素,离子会发生变化变成其它离子或分子等,但离子或分子中某种特定元素的原子的总数是不会改变的。如NaHCO3溶液中nc(Na+):nc(C)=1:1,
推出: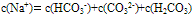
③质子守恒:电解质溶液中分子或离子得到或失去质子(H+)的物质的量应相等。例如在NH4HCO3溶液中H3O+、H2CO3为得到质子后的产物;NH3、OH-、CO32-为失去质子后的产物,故有以下关系: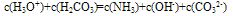
(2)粒子浓度大小比较的方法:
①单一溶液中离子浓度大小的比较
A. 一元弱酸盐溶液中离子浓度的关系是:
c(不水解离子)>c(水解离子)>c(显性离子)>c(水电离出的另一离子)
如:在CH3COONa溶液中各离子浓度大小关系: 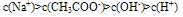
B. 二元弱酸盐溶液中离子浓度的关系是:
c(不水解离子)>c(水解离子)>c(显性离子)> c(二级水解离子)>c(水电离出的另一离子)
如:Na2CO3溶液中离子浓度的关系: 
②比较不同电解质溶液中同一种粒子浓度的大小。应注意弱酸、弱碱电离程度的大小以及影响电离度的因素,盐类水解及水解程度对该粒子浓度的影响。
③比较经过反应化学反应后离子浓度的大小:
A. 确定电解质溶液的成分
B. 确定溶液中含哪些粒子(分子、离子),此时要考虑物质的电离和水解情况
C. 确定各种粒子的浓度或物质的量的大小
D. 根据题目要求做出判断
注:要抓住“两小”。即弱电解质电离程度小,故未电离的弱电解质分子数远多于已电离出离子数目;盐的水解程度小,故未水解的粒子数目远多于水解生成的粒子数目
根据几种不同物质的性质不同及实验现象不同,将其一一区别开。
鉴别是根据化合物的不同性质来确定其含有什么官能团,是哪种化合物。如鉴别一组化合物,就是分别确定各是哪种化合物即可。在做鉴别题时要注意,并不是化合物的所有化学性质都可以用于鉴别,必须具备一定的条件:
(1)化学反应中有颜色变化
(2)化学反应过程中伴随着明显的温度变化(放热或吸热)
(3)反应产物有气体产生
(4)反应产物有沉淀生成或反应过程中沉淀溶解、产物分层等。
互滴现象不同的化学反应:
1.Na2CO3与稀盐酸的反应
(1)向稀盐酸中滴加Na2CO3溶液,立即有气泡产生。
(2)向Na2CO3溶液中滴加稀盐酸,边滴加边振荡,开始不产生气泡,后来产生气泡。
2.Ca(OH)2溶液与H3PO4溶液的反应
(1)向H3PO4溶液中滴加Ca(OH)2溶液,开始不产生白色沉淀,后来产生白色沉淀。
(2)向Ca(OH)2溶液中滴加H3PO4溶液,肝始有白色沉淀,后来白色沉淀逐渐消失。
3.NaOH溶液与AlCl3溶液的反应
(1)向AlCl3溶液中滴加NaOH溶液,开始产生白色沉淀,后来白色沉淀逐渐消失j
(2)向NaOH溶液中滴加AlCl3溶液,开始不产生白色沉淀,后来产生白色沉淀。
4.NaAlO2溶液与稀盐酸反应
(1)向NaAlO2溶液中滴加稀盐酸,开始有白色沉淀产生,后来白色沉淀逐渐消失。
(2)向稀盐酸中滴加NaAlO2溶液,开始不产生白色沉淀,后来产生白色沉淀。
5.AgNO3溶液与NH3·H2O反应
(1)向NH3·H2O中滴加AgNO3溶液,开始不产生沉淀 
(2)向AgNO3溶液中滴加NH3·H2O,开始出现沉淀,最终沉淀消失。
有机化合物的鉴别方法:
(1)烯烃、二烯、炔烃:
①溴的四氯化碳溶液,红色腿去
②高锰酸钾溶液,紫色腿去。
(2)含有炔氢的炔烃:
①硝酸银,生成炔化银白色沉淀
②氯化亚铜的氨溶液,生成炔化亚铜红色沉淀。
(3)小环烃:三、四元脂环烃可使溴的四氯化碳溶液腿色
(4)卤代烃:硝酸银的醇溶液,生成卤化银沉淀;不同结构的卤代烃生成沉淀的速度不同,叔卤代烃和烯丙式卤代烃最快,仲卤代烃次之,伯卤代烃需加热才出现沉淀。
(5)醇:
①与金属钠反应放出氢气(鉴别6个碳原子以下的醇);
②用卢卡斯试剂鉴别伯、仲、叔醇,叔醇立刻变浑浊,仲醇放置后变浑浊,伯醇放置后也无变化。
(6)酚或烯醇类化合物:
①用三氯化铁溶液产生颜色(苯酚产生兰紫色)。
②苯酚与溴水生成三溴苯酚白色沉淀。
(7)羰基化合物:
①鉴别所有的醛酮:2,4-二硝基苯肼,产生黄色或橙红色沉淀;
②区别醛与酮用托伦试剂,醛能生成银镜,而酮不能;
③区别芳香醛与脂肪醛或酮与脂肪醛,用斐林试剂,脂肪醛生成砖红色沉淀,而酮和芳香醛不能;
④鉴别甲基酮和具有结构的醇,用碘的氢氧化钠溶液,生成黄色的碘仿沉淀。
(8)甲酸:用托伦试剂,甲酸能生成银镜,而其他酸不能。
(9)胺:区别伯、仲、叔胺有两种方法
①用苯磺酰氯或对甲苯磺酰氯,在NaOH溶液中反应,伯胺生成的产物溶于NaOH;仲胺生成的产物不溶于NaOH溶液;叔胺不发生反应。
②用NaNO2+HCl:脂肪胺:伯胺放出氮气,仲胺生成黄色油状物,叔胺不反应。芳香胺:伯胺生成重氮盐,仲胺生成黄色油状物,叔胺生成绿色固体。
(10)糖:
①单糖都能与托伦试剂和斐林试剂作用,产生银镜或砖红色沉淀;
②葡萄糖与果糖:用溴水可区别葡萄糖与果糖,葡萄糖能使溴水褪色,而果糖不能。
③麦芽糖与蔗糖:用托伦试剂或斐林试剂,麦芽糖可生成银镜或砖红色沉淀,而蔗糖不能。
(11)使溴水褪色的有机物有:
①不饱和烃(烯、炔、二烯、苯乙烯等);
②不饱和烃的衍生物(烯醇、烯醛等);
③石油产品(裂化气、裂解气、裂化石油等);
④天然橡胶;
⑤苯酚(生成白色沉淀)。
(12)因萃取使溴水褪色的物质有:
①密度大于1的溶剂(四氯化碳、氯仿、溴苯、二硫化碳等);
②密度小于1的溶剂(液态的饱和烃、直馏汽油、苯及其同系物、液态环烷烃、液态饱和酯)。
(13)使酸性高锰酸钾溶液褪色的有机物有:
①不饱和烃;②苯的同系物;③不饱和烃的衍生物;④部分醇类有机物;⑤含醛基的有机物:醛、甲酸、甲酸酯、甲酸盐;⑥石油产品(裂解气、裂化气、裂化石油);⑦天然橡胶。
与“有A、B、C、D四种强电解质,它们在水中电离时可产生下列离子...”考查相似的试题有:
- 下列离子方程式中,不正确的是 ( )A.Na2S溶液中通入适量H2S:B.氧化铁溶于氢碘酸:C.过量铁粉加入稀HNO3溶液中:D.NaHS...
- 下列离子方程式书写正确的是( )A.NaHSO4溶液与Ba(OH)2溶液混合后溶液呈中性:H++SO42-+Ba2++OH-→BaSO4↓+H2OB.标准状况...
- 黄铜矿(CuFeS2)是制铜及其化合物的主要原料之一,还可以制备硫及铁的化合物。(1)冶炼铜的反应为8CuFeS2+21O28Cu+4FeO+...
- 下列离子方程式正确的是( )A.将氯气通入氯化亚铁溶液:2Fe2++Cl2=2Fe3++2Cl-B.钠与水的反应:Na+2H2O=Na++2OH-+H2↑C.铜...
- 下列反应的离子方程式正确的是A.Fe与FeCl3溶液反应: Fe + Fe3+= 2Fe2+B.往AlCl3溶液中滴入氨水:Al3++3OH-=Al(OH)3↓C....
- 已知NaHCO3溶液和NaOH溶液反应的离子方程式为:HCO3-+OH-=CO32-+H2O,NaHCO3在水中的电离方程式为:NaHCO3= Na++HCO3-,...
- 下列化学反应的离子方程式正确的是( )A.用小苏打治疗胃酸过多:HCO3-+ H+="=" CO2↑ + H2OB.往碳酸镁中滴加稀盐酸:CO32-+...
- 已知某溶液中仅存在四种离子,其浓度大小有如下关系,其中一定不正确的是[ ]A.B.C.D.
- 不用其他试剂进行物质的鉴别时一般会利用物质之间的相互反应进行鉴别。今有X、Y、Z、W四种无色 溶液,分别是盐酸、硝酸钡、碳...
- 用来鉴别CH4和C2H4,又可除去CH4中混有C2H4的方法是( )A.通入酸性KMnO4溶液中B.通入足量的溴水中C.点燃D.能入H2后加热