本试题 “在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图所示。请回答(1)“O”点导电能力为“0”的理由是 __________________________________。(2)A.B.C...” 主要考查您对强酸和弱酸的比较
弱电解质的电离度
导电性(单质、溶液、熔融状态导电)
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 强酸和弱酸的比较
- 弱电解质的电离度
- 导电性(单质、溶液、熔融状态导电)
强酸与弱酸(或强碱与弱碱)的比较:
1.强酸与弱酸(或强碱与弱碱)由于电离程度的不同,在很多方面表现出不同的性质 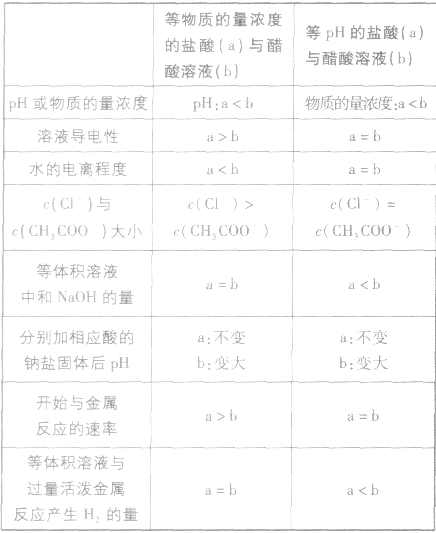
2.稀释时pH变化特点比较如下图:a、b分别为体积相等、pH相等的NaOH溶液和氨水的稀释曲线线;c、d分别为体积相等、pH相等的盐酸和醋酸溶液的稀释曲线,请体会图中的两层含义: 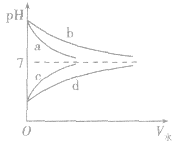
(1)加水稀释相同倍数后的pH大小:氨水>NaOH溶液,盐酸>醋酸溶液。若稀释10n倍,盐酸、Na0H溶液pH变化n个单位,而氨水与醋酸溶液pH变化小到 n个单位。
(2)稀释后的pH仍然相等,则加水量的大小:氨水 >NaOH溶液,醋酸溶液>盐酸。
电离度:
溶液中已电离的分子数占弱电解质分子总数的百分比称为电离度。
溶液中已电离的分子数占弱电解质分子总数的百分比称为电离度。
电解质溶液的导电性和导电能力:
1.金属靠自由电子的定向移动而导电,属于物理现象,温度升高时电阻增大,导电能力减弱。电解质溶液靠自由离子的定向移动而导电。电解质溶液(或熔融电解质)在导电的同时要发生化学变化,即被电解。
2.影响电解质溶液导电能力的因素
(1)自由移动离子浓度的大小(主要决定因素):温度一定,离子浓度越大,导电能力越强。
(2)温度:温度越高,导电能力越强(与金属导电相反)。
(3)单个离子所带电荷数:电荷数越高,导电能力越强。例如:氨水中通入少量HCl,原来的氨水是弱电解质溶液,离子浓度较小,导电能力较弱,当通入少量HCl 转变成NH4Cl时,因NH4Cl完全电离,离子浓度明显增大,故导电能力增强。
3.强电解质溶液的导电能力不一定比弱电解质溶液的强。例如:较浓醋酸的导电能力比极稀HCl溶液强,这是由溶液中自南移动离子浓度大小决定的。又如:CaCO3虽为强电解质,但溶于水所得溶液极稀,自由移动离子的浓度太小,溶液导电能力极差。
1.金属靠自由电子的定向移动而导电,属于物理现象,温度升高时电阻增大,导电能力减弱。电解质溶液靠自由离子的定向移动而导电。电解质溶液(或熔融电解质)在导电的同时要发生化学变化,即被电解。
2.影响电解质溶液导电能力的因素
(1)自由移动离子浓度的大小(主要决定因素):温度一定,离子浓度越大,导电能力越强。
(2)温度:温度越高,导电能力越强(与金属导电相反)。
(3)单个离子所带电荷数:电荷数越高,导电能力越强。例如:氨水中通入少量HCl,原来的氨水是弱电解质溶液,离子浓度较小,导电能力较弱,当通入少量HCl 转变成NH4Cl时,因NH4Cl完全电离,离子浓度明显增大,故导电能力增强。
3.强电解质溶液的导电能力不一定比弱电解质溶液的强。例如:较浓醋酸的导电能力比极稀HCl溶液强,这是由溶液中自南移动离子浓度大小决定的。又如:CaCO3虽为强电解质,但溶于水所得溶液极稀,自由移动离子的浓度太小,溶液导电能力极差。
发现相似题
与“在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图所...”考查相似的试题有:
- 在相同温度时,100mL0.01mol/L的醋酸溶液与10mL 0.1mol/L的醋酸溶液相比较,下列数值中,前者大于后者的是[ ]A.H+的物质的...
- 电导率可用于衡量电解质溶液导电能力大小。室温下,用0.100 mol·L-1NH3·H2O溶液滴定10.00 mL浓度均为0.100 mol·L-1盐酸和CH3CO...
- 下列物质中属于强电解质的是A.NH3·H2OB.H2OC.CH3COOHD.醋酸铵
- 现有常温下的五种溶液(如下表)。下列有关叙述中正确的是A.五种溶液中,水电离出的c(OH-)最小的是⑤B.将①、④两种溶液等体...
- 某温度下,相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积变化的曲线如下图所示。据图判断正确的是A.Ⅱ为盐酸稀释时的pH...
- (14分)下列物质中:①NaCl ②Na2O ③CH3COOH ④CO2 ⑤NaHCO3 ⑥NH3·H2O ⑦HCl ⑧NaOH ⑨Cl2 ⑩酒精 请按要求回答下列问题(填...
- (1)常温下,有0.1mol/L的盐酸和0.1mol/L的醋酸溶液,回答下列问题:①比较两溶液的pH,盐酸 (填“”)醋酸,写出醋酸电离的方程...
- 25℃时,在等体积的①ph=0的溶液、②0.05mol/L的溶液、③ph=10的溶液、④pH=5的溶液中,发生电离的水的物质的量之比是A.1:10:10:1...
- 为证明某可溶性一元酸(HX)是弱酸,有如下实验方案,其中不合理的是A.室温下,测0.1 mol/L HX溶液的pH,若pH>1,证明HX是...
- 下列物质中,能够导电的是( ) A.二氧化碳气体 B.盐酸溶液 C.蔗糖溶液 D.固体氯化钠