本试题 “.海水中含有丰富的化学元素,下面是某化工厂从海水中提取NaCl、Mg(以MgCl2形式存在)和Br2(以NaBr的形式存在)及综合利用的生产流程简图:请回答:(1)在...” 主要考查您对原电池原理
电解池原理
物质的分离
海水资源的综合利用
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 原电池原理
- 电解池原理
- 物质的分离
- 海水资源的综合利用
1.定义:将化学能转化为电能的装置。
2.工作原理:
以铜-锌原电池为例

(1)装置图:

(2)原理图:

3.实质:化学能转化为电能。
4.构成前提:能自发地发生氧化还原反应。
5.电极反应:
负极:失去电子;氧化反应;流出电子
正极:得到电子;氧化反应;流入电子
6.原电池正负极判断的方法:
①由组成原电池的两级材料判断,一般是活泼金属为负极,活泼性较弱的金属或能导电的非金属为正极。
②根据电流方向或电子流动方向判断,电流是由正极流向负极,电子流动方向是由负极流向正极。
③根据原电池里电解质溶液内离子的定向移动方向,在原电池的电解质溶液中,阳离子移向正极,阴离子移向负极。
④根据原电池两级发生的变化来判断,原电池的负极总是失电子发生氧化反应,正极总是得电子发生还原反应。
⑤X极增重或减重:X极质量增加,说明溶液中的阳离子在X极(正极)放电,反之,X极质量减少,说明X极金属溶解,X极为负极。
⑥X极有气泡冒出:发生可析出氢气的反应,说明X极为正极。
⑦X极负极pH变化:析氢或吸氧的电极发生反应后,均能使该电极附近电解质溶液的pH增大,X极附近的pH增大,说明X极为正极。
原电池中的电荷流动:
在外电路(电解质溶液以外),电子(负电荷)由负极经导线(包括电流表和其他用电器)流向正极,使负极呈正电性趋势、正极呈负电性趋势。在内电路(电解质溶液中),阳离子(带正电荷)向正极移动,阴离子 (带负电荷)向负极移动。这样形成了电荷持续定向流动,电性趋向平衡的闭合电路。
(1)电解:使电流通过电解质溶液且在阴、阳极两极引起氧化还原反应的过程叫电解。
(2)装置:电解池(电解槽)
(3)特点:将电能转化为化学能。
形成条件:①与电源相连的两个电极,②电解质溶液或熔融电解质,③形成闭合回路
(4)阴离子放电顺序:S2->I->Br->Cl->OH->SO42->NO3->F- 阳离子放电顺序:Ag+>Hg2+>Fe3+>Cu2+>H+>Pb2+>Sn2+>Fe2+>Zn2+>Al3+>Mg2+>Na+>Ca2+>K+
(5)电解时溶液pH值的变化规律电解质溶液在电解过程中,有时溶液pH值会发生变化。判断电解质溶液的pH值变化,有时可以从电解产物上去看。
①若电解时阴极上产生H2(消耗H+),阳极上无O2产生,电解后溶液pH值增大;
②若阴极上无H2,阳极上产生O2,则电解后溶液pH值减小;
③若阴极上有H2,阳极上有O2,且(相当于电解水),则有三种情况:
a如果原溶液为中性溶液,则电解后pH值不变;
b如果原溶液是酸溶液,则pH值变小;
c如果原溶液为碱溶液,则pH值变大;
④若阴极上无H2,阳极上无O2产生,电解后溶液的pH可能也会发生变化。如电解CuCl2溶液(CuCl2溶液由于Cu2+水解显酸性),一旦CuCl2全部电解完,pH值会变大,成中性溶液。
(6)电解反应类型:从参加反应的物质来分电解反应可分成五类:
①H2O型:实质是电解水。如电解硝酸钠、氢氧化钠、硫酸等溶液。
②溶质型:溶质所电离出来的离子发生氧化还原,如电解氯化铜、溴化氢等溶液。
③硫酸铜溶液型:电解产物是金属、氧气与酸。如电解硫酸铜溶液生成单质铜、氧气和硫酸,电解硝酸银溶液时生成单质银、氧气和硝酸。
④氯化钠溶液型:电解产物是非金属单质、氢气与碱。如电解氯化钠溶液时生成氯气、氢气和氢氧化钠,电解溴化钾溶液时生成溴单质、氢气和氢氧化钾。
⑤电镀型:镀层金属作阳极,阳极反应是:M-ne-=Mn+,镀件作阴极,阴极反应是:Mn++ne-=M。(电解精炼与电镀,实质上是相同的)
原电池、电解池、电镀池的比较:


分离与提纯的原则和要求:
(1)选择分离与提纯方法应遵循的原则
①不增:指不能引入新的杂质。
②不减:指应尽可能减少被分离与提纯的物质的损失。
③易分离:指如果使用试剂除去杂质时,要求反应后的产物跟被提纯的物质容易分离。
④易复原:指分离物或被提纯的物质都要容易复原。
(2)分离与提纯操作过程应遵循“三必须”
①除杂质试剂必须过量;
②过量试剂必须除尽(因过量试剂会带人新的杂质);
③除杂途径必须选最佳。
常见的分离与提纯的方法:
(1)物质分离与提纯常用的物理方法
| 方法 | 适用范围或原理 | 装置 | 举例 | 注意事项 |
| 过滤 | 分离固体和液体混合物 | 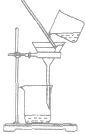 |
粗盐提纯时把粗盐溶于水,经过滤把不溶于水的杂质除去 | ①要“一贴二低三靠” 滤纸紧贴漏斗内壁;滤纸边缘低于漏斗口,漏斗里液面低于滤纸边缘;烧杯口紧靠玻璃棒,玻璃捧下端紧靠三层滤纸.漏斗下端紧靠烧杯内壁。 ②必要时洗涤沉淀物(在过滤器中加少量水),不可搅拌 |
| 结晶 重结晶 |
分离各组分在溶剂中的溶解度随温度变化不同的混合物 | 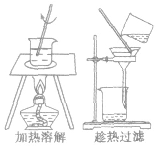 |
KNO3溶解度随温度变化大, NaCl溶解度随温度变化小,可用该法从二者的混合液中提纯KNO3 | ①一般先配较高温度下的浓溶液,然后降温结晶 ②结晶后过滤,分离出晶体 |
| 蒸发 | 溶解度随温度变化较小的物质 |  |
从食盐水溶液中提取食盐晶体 | ①溶质应不易分解、不易水解、不易被氧气氧化 ②蒸发过程应不断搅拌 ③近干时停止加热,余热蒸干 |
| 蒸馏 | 分离沸点不同的液体混合物 | 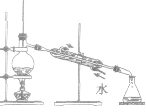 |
制无水乙醇(加生石灰)、硝酸的浓缩[加浓硫酸或 Mg(NO3)2] | ①温度计水银球在蒸馏烧瓶支管口处 ②加沸石(碎瓷片) ③注意冷凝管水流方向应下进上出 ④不可蒸干 |
| 分馏 | 分离多种液态混合物 | 同蒸馏 | 石油分馏 | 同蒸馏 |
| 萃取 | 分离两种互溶的液体 |  |
CCl4把溴水中的Br2萃取出来 |
①萃取后再进行分液操作 ②对萃取剂的要求:与原溶剂互不混溶,不反应;溶质在其中的溶解度比在原溶剂中大;溶质不与萃取剂反应 ③萃取后得到的仍是溶液,一般要通过分馏等方法进一步分离 |
| 分液 | 分离两种不相混溶的液体(密度不同) | 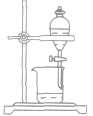 |
水、苯的分离 | 下层液体从下口放出,上层液体从上口倒出 |
| 液化 | 利用气体混合物中某组分易液化的特点来分离 | 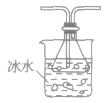 |
除去SO2中的SO3 | 可把锥形瓶换成硬质大试管 |
| 盐析 | 利用某些物质在加某些无机盐时,其溶解度降低而凝聚的性质来分离物质 | —— | 从皂化液中分离肥皂、甘油,蛋白质的盐析 | 盐析是物理变化。盐析之后一般要采取过滤的操作 |
| 洗气 | 杂质气体易溶于某液体 | 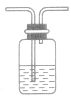 |
除去CO2中的HCl气体,可使混合气体通过盛有饱和NaHCO3 溶液的洗气瓶 | ①从洗气瓶的长导管一端进气 ②混合物中气体溶解度差别较大 |
| 升华 | 利用某些物质有升华的特性 |  |
粗碘中碘与钾、钠、钙、镁的碘化物混合,利用碘易升华的特点将碘与杂质分开 | 升华物质的集取方法不作要求 |
| 渗析 | 胶体提纯、精制 | 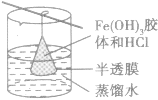 |
除去Fe(OH)3胶体中的HCl | 要不断更换烧杯中的水或改用流动水,以提高渗析效果 |
(2)物质分离与提纯常用的化学方法:
①加热法
混合物中混有某些热稳定性差的物质时,可直接加热,使热稳定性差的物质分解而分离出来。例如:食盐中混有氯化铵、纯碱中混有小苏打等均可直接加热除去杂质。
②沉淀法
在混合物中加入某试剂,使其中一种以沉淀形式分离出去的方法。使用该方法一定要注意不能引入新杂质,若使用多种试剂将溶液中不同粒子逐步沉淀时,应注意后加入试剂能将先加入的过量试剂除去,最后加入的试剂不引入新杂质。例如:加入适量BaCl2溶液可除去NaCl中混有的Na2SO4。
③转化法
利用化学反应将某种物质进行多次转化而分离。例如:分离Fe3+和Al3+时,可加入过量的NaOH溶液,生成Fe(OH)3和NaAlO2,过滤后,分别再加盐酸重新生成Fe3+和Al3+。注意转化过程中尽量减少被分离物质的损失.而且转化后的物质要易恢复为原物质。
④酸碱法
被提纯物质不与酸或碱反应,而杂质可与酸或碱发生反应,可用酸或碱作除杂试剂。例如:用盐酸除去 SiO2中的石灰石,用氢氧化钠除去铁粉中的铝粉。
⑤氧化还原法
a.对混合物中混有的还原性杂质,可加入适当的氧化剂将杂质氧化为被提纯物质。例如:将氯水滴入混有FeCl2的FeCl3溶液中,除去FeCl2杂质。
b.对混合物中混有的氧化性杂质,可加入适当还原剂将杂质还原为被提纯物质。例如:将过量铁粉加入混有FeCl3的FeCl2溶液中,振荡过滤,除去FeCl3 杂质。
⑥调节pH法
通过加入试剂来调节溶液的pH,使溶液中某组分沉淀而分离的方法。一般加入相应的难溶或微溶物来调节。例如:在CaCl2溶液中含有FeCl3杂质,由于 Fe3+水解,溶液呈酸性,可采用调节溶液pH的方法将 Fe3+沉淀除去,为此,可向溶液中加氧化钙或氢氧化钙或碳酸钙等。
⑦电解法
此法利用电解原理来分离、提纯物质。例如:电解精炼铜,将粗铜作阳极,精铜作阴极,电解液为含铜离子的溶液,通直流电,在阳极铜及比铜活泼的杂质金属失电子,在阴极只有铜离子得电子析出,从而提纯了铜。
浩瀚的海洋是个巨大的资源宝库,它不仅孕育着无数的生命,还孕育着丰富的矿产,而海水本身含有大量的化学物质,又是宝贵的化学资源。可从海水中提取大量的食盐、镁、溴、碘、钾等有用物质,海水素有“液体工业原料”之美誉。
海水制盐:
(1)海水制盐的方法:从海水中得到食盐的方法有蒸发法(盐田法)、电渗析法等。目前,以蒸发法(盐田法)为主。
(2)海水晒盐的基本原理:水分不断蒸发,氯化钠等盐结晶析出。
(3)海水晒盐的流程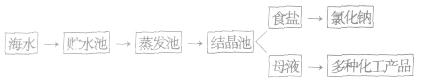
氯碱工业:
(1)食盐水的精制
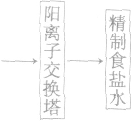
(2)电极反应
阴极: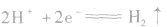
阳极:
总反应: :
:
(3)主要设备
离子交换膜电解槽一一阳极用金属钛(表面涂有钛、钉氧化物层)制成,阴极用碳钢(覆有镍镀层)制成。阳离子膜具有选择透过性,只允许Na+透过,而Cl-、 OH一和气体不能透过。 
(4)产品及用途
烧碱:可用于造纸、玻璃、肥皂等工业
氯气:可用于制农药、有机合成、氯化物的合成
氢气:可用于金属冶炼、有机合成、盐酸的制取
海水提溴:
(1)氯化
氯化氧化溴离子,在pH=3.5的酸性条件下效果最好,所以在氯化之前要将海水酸化。
(2)吹出
当海水中的Br一被氧化成Br2以后,用空气将其吹出。另外,也可以用水蒸气,使溴和水蒸气一起蒸出。
(3)吸收
目前比较多的是用二氧化硫作还原剂,使溴单质转化为HBr,再用氯气将其氧化得到溴产品。化学方程式如下: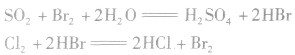
海水提镁:
(1)工艺流程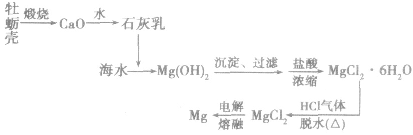
(2)主要化学反应
①制备石灰乳: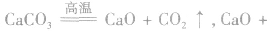
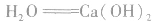
②沉淀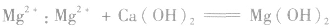
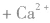
③制备
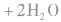
从海水中提取重水:
提取重水的方法:蒸馏法、电解法、化学交换法、吸附法等。常用方法:化学交换法(硫化氢一水双温交换法)
铀和重水目前是核能开发中的重要原料,从海水中提取铀和重水对一个国家来说具有战略意义,化学在开发海洋药物方面也将发挥越来越大的作用。潮汐能、波浪能也是越来越受到重视的新型能源。
与“.海水中含有丰富的化学元素,下面是某化工厂从海水中提取NaC...”考查相似的试题有:
- 某同学根据原电池原理设计了“苹果电池”(如图),下列有关说法中正确的是( )A.苹果里有电解质溶液B.铁片是此“苹果电池”的...
- 下列图像表达正确的是A.稀硫酸的稀释B.等量的盐酸与过量的锌粉反应C.氢气与氧气反应中的能量变化D.气态氢化物沸点
- 用惰性电极电解下列足量溶液,一段时间后,再加入一定量的另一种物质(括号内物质),溶液与原来溶液完全一样的是 ( )A.NaCl...
- 下列说法正确的是( )①可用电解饱和NaCl溶液的方法制取金属钠②铝热反应一定是氧化还原反应③以煤、石油和天然气为原料,通过...
- 锌空气燃料电池具有安全、零污染、高能量、大功率、低成本及材料可再生等优点,因而被专家们认为是装备电动汽车等的理想动力...
- 用惰性电极电解M(NO3)x的水溶液,当阴极上增重ag时,在阳极上同时产生bL氧气(标准状况),则M的相对原子质量为( )A.B.C...
- 将0.23 mol SO2和0.11 mol O2放入容积为1 L的密闭容器中,发生反应2SO2+O22SO3,在一定温度下,反应达到平衡,得到0.12 mol ...
- 下列实验操作中错误的是 ( )A.蒸发操作时,将混合物中的水分完全蒸干后才停止加热B.蒸馏操作时,应使温度计水银球与蒸馏烧...
- (10分)欲用含有少量氯化钙的氯化钠固体,配制100 mL 1mol/L的氯化钠溶液,设计了下面的操作方案。根据方案操作步骤回答下列问...
- 下列各组混合物的分离或提纯应采用什么方法最合适?(1)除去Ca(OH)2溶液中悬浮的CaCO3颗粒,用 方法;(2)除去乙醇中溶解...