本试题 “关于强弱电解质的叙述不正确的是A.强电解质在溶液中完全电离,不存在电离平衡B.同一弱电解质溶液,温度不同时,导电能力不同C.强电解质溶液导电能力一定很...” 主要考查您对强电解质、弱电解质
电解质、非电解质
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 强电解质、弱电解质
- 电解质、非电解质
强电解质:
在水溶液里或熔融状态下,能全部电离的化合物。包括:强酸、强碱、大多数盐、活泼金属氧化物等;完全电离、不可逆、不存在电离平衡;电离方程式用“=”表示。
弱电解质:
在水溶液里或熔融状态下,不能全部电离的化合物。包括:弱酸、弱碱、少数盐等;部分电离、可逆、存在电离平衡,电离方程式用“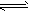 ”表示。
”表示。
在水溶液里或熔融状态下,能全部电离的化合物。包括:强酸、强碱、大多数盐、活泼金属氧化物等;完全电离、不可逆、不存在电离平衡;电离方程式用“=”表示。
弱电解质:
在水溶液里或熔融状态下,不能全部电离的化合物。包括:弱酸、弱碱、少数盐等;部分电离、可逆、存在电离平衡,电离方程式用“
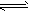 ”表示。
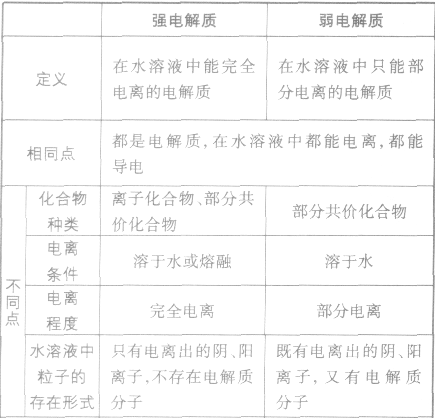
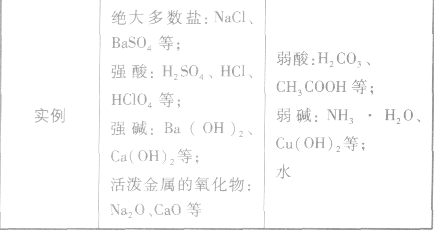
”表示。 强电解质和弱电解质的比较:
强弱电解质的判断依据:
1.在相同浓度、相同温度下,与强电解质做导电性对比实验.
2.浓度与pH的关系。如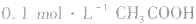 溶液的pH>1,则证明
溶液的pH>1,则证明 是弱电解质。
是弱电解质。
3.测定对应盐溶液的酸碱性。如 溶液呈碱性,则证明醋酸是弱电解质。
溶液呈碱性,则证明醋酸是弱电解质。
4.稀释前后的pH变化与稀释倍数的关系。例如,将pH=2的酸溶液稀释1000倍,若pH<5,则证明该酸为弱电解质;若pH=5,则证明该酸为强电解质。
5.采用实验证明电离平衡。如向醋酸溶液中滴人石蕊试液,溶液变红,再加入醋酸钠晶体,颜色变浅。
电解质和非电解质:
1.电解质和非电解质在水溶液里或熔融状态下能导电的化合物,叫做电解质。在水溶液里和熔融状态下都不导电的化合物,叫做非电解质。
2.电解质和非电解质的比较

说明(1)电解质、非电解质均是化合物。
(2)电解质导电必须有外界条件:水溶液或熔融状态。
(3)电解质是一定条件下本身电离而导电的化合物。CO2、SO2、SO3、NH3溶于水后也导电,但是与水反应生成的新物质电离而导电的,不是本身电离而导电的,故属于非电解质。
(4)电解质的强弱由物质的内部结构决定,与其溶解度无关。某些难溶于水的化合物,如BaSO4、AgCl,虽然溶解度很小,但溶解的部分是完全电离的,所以是强电解质。
(5)电解质不一定导电,非电解质一定不导电;导电的物质不一定是电解质,不导电的物质不一定是非电解质。
1.电解质和非电解质在水溶液里或熔融状态下能导电的化合物,叫做电解质。在水溶液里和熔融状态下都不导电的化合物,叫做非电解质。
2.电解质和非电解质的比较

说明(1)电解质、非电解质均是化合物。
(2)电解质导电必须有外界条件:水溶液或熔融状态。
(3)电解质是一定条件下本身电离而导电的化合物。CO2、SO2、SO3、NH3溶于水后也导电,但是与水反应生成的新物质电离而导电的,不是本身电离而导电的,故属于非电解质。
(4)电解质的强弱由物质的内部结构决定,与其溶解度无关。某些难溶于水的化合物,如BaSO4、AgCl,虽然溶解度很小,但溶解的部分是完全电离的,所以是强电解质。
(5)电解质不一定导电,非电解质一定不导电;导电的物质不一定是电解质,不导电的物质不一定是非电解质。
发现相似题
与“关于强弱电解质的叙述不正确的是A.强电解质在溶液中完全电离...”考查相似的试题有:
- 下列状态的物质,既能导电又属于电解质的是A.KCl溶液B.液态HClC.熔融的NaOHD.蔗糖溶液
- (4分)写出下列物质在水溶液中的电离方程式(1)氯化铜 (2)硫酸铁
- 下列物质能导电,而且属于电解质的是A.水银B.无水乙醇C.氯化钠溶液D.熔融的硫酸铜
- 有以下几种物质①干燥的食盐晶体②液态氯化氢③水银④蔗糖⑤冰醋酸⑥KNO3溶液⑦SO3,填空回答:(填序号)(1)以上物质中属于电解质...
- 写电离方程式:(1)H2SO4 ; (2)NaHCO3 ; ;
- 下列物质属于强电解质且能导电的是( )①氯化钠溶液 ②氯化铵固体 ③铜 ④石墨 ⑤熔融NaOH ⑥稀硫酸 ⑦乙酸 ⑧乙醇.A.⑤B.②⑤C.①②⑤...
- 下列属于电解质的是A.蔗糖B.盐酸C.酒精D.氢氧化钠
- 下列物质在水中部分电离且属于电解质的是( )A.NaOHB.CH3COOHC.H2SO4D.CO2
- 现有以下物质:①NaCl晶体, ②液态SO3, ③液态醋酸, ④汞,⑤BaSO4固体,⑥蔗糖(C12H22O11),⑦酒精(C2H5OH),⑧熔融KNO3请回...
- 下列关于强、弱电解质的叙述,有错误的是A.强电解质在溶液中完全电离,不存在电离平衡B.在溶液中,导电能力强的电解质是强...