本试题 “下列各组比较中,前者比后者大的是[ ]A.25℃时,pH均为2的H2SO4溶液和盐酸中氢离子的物质的量浓度B.25℃时,pH均为2的盐酸和CH3COOH溶液中溶质的物质的量浓度...” 主要考查您对弱电解质的电离度
导电性(单质、溶液、熔融状态导电)
水电离的影响因素
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 弱电解质的电离度
- 导电性(单质、溶液、熔融状态导电)
- 水电离的影响因素
电离度:
溶液中已电离的分子数占弱电解质分子总数的百分比称为电离度。
溶液中已电离的分子数占弱电解质分子总数的百分比称为电离度。
电解质溶液的导电性和导电能力:
1.金属靠自由电子的定向移动而导电,属于物理现象,温度升高时电阻增大,导电能力减弱。电解质溶液靠自由离子的定向移动而导电。电解质溶液(或熔融电解质)在导电的同时要发生化学变化,即被电解。
2.影响电解质溶液导电能力的因素
(1)自由移动离子浓度的大小(主要决定因素):温度一定,离子浓度越大,导电能力越强。
(2)温度:温度越高,导电能力越强(与金属导电相反)。
(3)单个离子所带电荷数:电荷数越高,导电能力越强。例如:氨水中通入少量HCl,原来的氨水是弱电解质溶液,离子浓度较小,导电能力较弱,当通入少量HCl 转变成NH4Cl时,因NH4Cl完全电离,离子浓度明显增大,故导电能力增强。
3.强电解质溶液的导电能力不一定比弱电解质溶液的强。例如:较浓醋酸的导电能力比极稀HCl溶液强,这是由溶液中自南移动离子浓度大小决定的。又如:CaCO3虽为强电解质,但溶于水所得溶液极稀,自由移动离子的浓度太小,溶液导电能力极差。
1.金属靠自由电子的定向移动而导电,属于物理现象,温度升高时电阻增大,导电能力减弱。电解质溶液靠自由离子的定向移动而导电。电解质溶液(或熔融电解质)在导电的同时要发生化学变化,即被电解。
2.影响电解质溶液导电能力的因素
(1)自由移动离子浓度的大小(主要决定因素):温度一定,离子浓度越大,导电能力越强。
(2)温度:温度越高,导电能力越强(与金属导电相反)。
(3)单个离子所带电荷数:电荷数越高,导电能力越强。例如:氨水中通入少量HCl,原来的氨水是弱电解质溶液,离子浓度较小,导电能力较弱,当通入少量HCl 转变成NH4Cl时,因NH4Cl完全电离,离子浓度明显增大,故导电能力增强。
3.强电解质溶液的导电能力不一定比弱电解质溶液的强。例如:较浓醋酸的导电能力比极稀HCl溶液强,这是由溶液中自南移动离子浓度大小决定的。又如:CaCO3虽为强电解质,但溶于水所得溶液极稀,自由移动离子的浓度太小,溶液导电能力极差。
影响水电离平衡的因素:
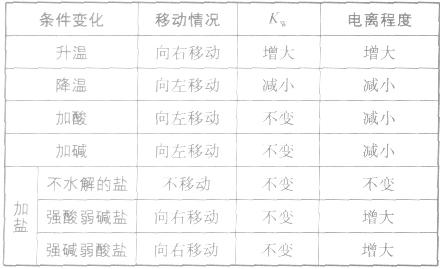
发现相似题
与“下列各组比较中,前者比后者大的是[ ]A.25℃时,pH均为2的H2S...”考查相似的试题有:
- 用蒸馏水稀释0.1mol/L的CH3COOH时,始终保持增大趋势的是( )A. c(CH3COOH)B.c(H+)C.c(OH-)D.c(CH3COO-)
- (12分)⑴① NH3 ②SO3 ③Cl2 ④BaSO4 ⑤酒精 ⑥CH3COONH4 ⑦HClO ⑧Cu。以上物质中属于非电解质的是 ,属于强电解质的是 。⑵常温下...
- 在100mL0.1mol/L 的醋酸溶液中,欲使醋酸的电离程度增大,H+浓度减小,可采用方法是( ) A 加热。 B 加入0.1mol/L 的醋酸溶...
- 已知某温度下,几种酸的电离常数如下:Ka(HCN)= 6.2×10-10mol·L-1、Ka(HF)= 6.8×10-4mol·L-1、Ka(CH3COOH)= 1.8×10-5mol·L...
- 在相同温度下,100mL 0.1mol·L-1的醋酸与10mL 1mol·L-1的醋酸相比较,下列说法正确的是A.溶液中H+的物质的量前者大于后者...
- 常温下,水的离子积为Kw,下列说法正确的是( )A.在pH=11的溶液中,水电离出的c(OH-)一定等于10-3mol/LB.将pH=1的酸和pH...
- 把1mL 0.1mol/L的H2SO4加水稀释成2L溶液,在此溶液中由水电离产生的H+,其浓度接近于( )A.1×10-4mol/LB.1×10-8mol/LC.1×...
- 现有两瓶温度分别为15℃和45℃,pH均为l的硫酸溶液,下列有关说法不正确的是A.两溶液中的c(OH-)相等B.两溶液中的c(H+)相...
- 硼酸(H3BO3)分子的中心原子B最外层电子并未达到饱和,它在水中结合水分子电离出来的OH-使B原子最外层电子达到饱和,其过程如...
- 下列叙述正确的是A.c(NH4+)相等的(NH4)2SO4、(NH4)2Fe(SO4)2和NH4Cl溶液中,溶质浓度大小关系是:c[(NH4)2Fe(SO4)2]<c[(NH4...