本试题 “对一些生活中的事实解释合理的是( )A.纸张燃烧后,余烬质量比纸张质量减少,说明该反应不遵循质量守恒定律B.洗涤剂能清除油污,是因为它具有乳化作用C....” 主要考查您对浓硫酸的稀释
质量守恒定律
乳化和乳化作用
构成物质的微粒(分子、原子、离子)
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 浓硫酸的稀释
- 质量守恒定律
- 乳化和乳化作用
- 构成物质的微粒(分子、原子、离子)
浓硫酸:
俗称坏水。坏水指浓度大于或等于70%的硫酸溶液。浓硫酸在浓度高时具有强氧化性,这是它与普通硫酸或普通浓硫酸最大的区别之一。同时它还具有脱水性,强氧化性,难挥发性,酸性,稳定性,吸水性等。
浓硫酸的稀释:
稀释浓硫酸时,一定要将浓硫酸沿着器壁慢慢地注入水里,并不断搅拌,使产生的热量迅速地扩散,切不可把水倒入浓硫酸中,因为水的密度较小,浮在浓硫酸上面,溶解时放出的热会使水立刻沸腾。使硫酸液滴向四周飞溅,这是非常危险的(如下图)。若不慎将浓硫酸沾到皮肤上,应立即用大量水冲洗,然后涂上3%一5%的 NaHCO3溶液。
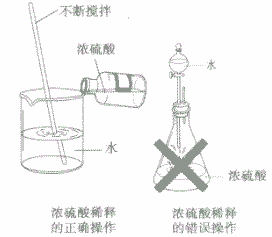
切记“酸入水,沿器壁,慢慢倒,不断搅”。注酸入水不断搅拌
俗称坏水。坏水指浓度大于或等于70%的硫酸溶液。浓硫酸在浓度高时具有强氧化性,这是它与普通硫酸或普通浓硫酸最大的区别之一。同时它还具有脱水性,强氧化性,难挥发性,酸性,稳定性,吸水性等。
浓硫酸的稀释:
稀释浓硫酸时,一定要将浓硫酸沿着器壁慢慢地注入水里,并不断搅拌,使产生的热量迅速地扩散,切不可把水倒入浓硫酸中,因为水的密度较小,浮在浓硫酸上面,溶解时放出的热会使水立刻沸腾。使硫酸液滴向四周飞溅,这是非常危险的(如下图)。若不慎将浓硫酸沾到皮肤上,应立即用大量水冲洗,然后涂上3%一5%的 NaHCO3溶液。

切记“酸入水,沿器壁,慢慢倒,不断搅”。注酸入水不断搅拌
质量守恒定律的概念及对概念的理解:
(1)概念:参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。这个规律就叫做质量守恒定律。
(2)对概念的理解:
①质量守恒定律只适用于化学反应,不能用于物理变化例如,将2g水加热变成2g水蒸气,这一变化前后质量虽然相等,但这是物理变化,不能说它遵守质量守恒定律。
②质量守恒定律指的是“质量守恒”,不包括其他方面的守恒,如对反应物和生成物均是气体的反应来说,反应前后的总质量守恒,但是其体积却不一定守恒。
③质量守恒定律中的第一个“质量”二字,是指“参加”化学反应的反应物的质量,不是所有反应物质量的任意简单相加。
例如,2g氢气与8g氧气在点燃的条件下,并非生成10g水,而是1g氢气与8g氧气参加反应,生成9g水
④很多化学反应中有气体或沉淀生成,因此“生成的各物质质量总和”包括了固态、液态和气态三种状态的物质,不能把生成的特别是逸散到空气中的气态物质计算在“总质量”之外而误认为化学反应不遵循质量守恒定律
质量守恒定律的微观实质:
(1)化学反应的实质在化学反应过程中,参加反应的各物质(反应物) 的原子,重新组合而生成其他物质(生成物)的过程。由分子构成的物质在化学反应中的变化过程可表示为:

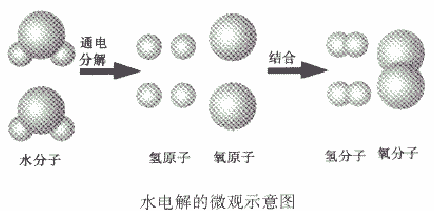
(2)质量守恒的原因在化学反应中,反应前后原子的种类没有改变,数目没有增减,原子本身的质量也没有改变,所以,反应前后的质量总和必然相等。例如,水通电分解生成氢气和氧气,从微观角度看:当水分子分解时,生成氢原子和氧原子,每两个氢原子结合成一个氢分子,每两个氧原子结合成一个氧分子。
质量守恒定律的延伸和拓展理解:
质量守恒定律要抓住“六个不变”,“两个一定变”“两个可能变”。
如从水电解的微观示意图能得出的信息:
①在化学反应中,分子可以分成原子,原子又重新组合成新的分子;
②一个水分子是由两个氢原子和一个氧原子构成的,或一个氧分子由两个氧原子构成、一个氧分子由两个氢原子构成。或氢气、氧气是单质,水是化合物
③原子是化学变化中的最小粒子。
④水是由氢、氧两种元素组成的。
⑤在化学反应,氧元素的种类不变。
⑥在化学反应中,原子的种类、数目不变。
⑦参加反应的各物质的质量总和等于反应后生成的各物质的质量总和。
质量守恒定律的发现:
1. 早在300多年前,化学家们就对化学反应进行定量研究。1673年,英国化学家波义耳(RobertBoyle, 1627-1691)在一个敞口的容器中加热金属,结果发现反应后容器中物质的质量增加了。
2. 1756年,俄国化学家罗蒙诺索夫把锡放在密闭的容器里锻烧,锡发生变化,生成白色的氧化锡,但容器和容器里物质的总质量,在锻烧前后并没有发生变化。经过反复实验,都得到同样的结果,于是他认为在化学变化中物质的质量是守恒的。
3. 1774年,法国化学家拉瓦锡用精确的定量实验法,在密封容器中研究氧化汞的分解与合成中各物质质量之间的关系,得到的结论是:参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。
4. 后来.人们用先进的测址仪器做了大量精度极高的实验,确认拉瓦易的结论是正确的。从此,质量守恒定律被人们所认识。
质量守恒定律的应用:
(1)解释问题
①解释化学反应的本质—生成新物质,不能产生新元素(揭示伪科学的谎言问题)。
②解释化学反应前后物质的质量变化及用质量差确定某反应物或生成物。
(2)确定反应物或生成物的质量
确定反应物或生成物的质量时首先要遵循参加反应的各种物质的质量总量等于生成的各种物质的质量总和;其次各种物质的质量比等于相对分子质量与化学计量数的乘积之比。
(3)确定物质的元素组成
理解在化学反应前后,元素的种类不发生改变。可通过计算确定具体的元素质量。
(4)确定反应物或生成物的化学式
比较反应前后各种原子个数的多少,找出原子个数的差异。但不能忘记化学式前的化学计量数。
(5)确定某物质的相对分子质量(或相对原子质量)
运用质量守恒定律确定某物质的相对分子质量 (或相对原子质量)时,首先寻找两种已知质量的物质,再根据化学方程式中各物质间的质量成正比即可计算得出。注意观察物质化学式前面的化学计量数。
(6)确定化学反应的类型
判定反应的类型,首先根据质量守恒定律判断反应物、生成物的种类和质量(从数值上看,反应物质量减少,生成物质最增加)。如果是微观示意图,要对比观察减少的粒子和增加的粒子的种类和数目再进行判断。
(7)判断化学方程式是否正确
根据质量守恒定律判断化学方程式的对与否关键是看等号两边的原子总数是否相等,同时注意化学式书写是否有误。
(1)概念:参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。这个规律就叫做质量守恒定律。
(2)对概念的理解:
①质量守恒定律只适用于化学反应,不能用于物理变化例如,将2g水加热变成2g水蒸气,这一变化前后质量虽然相等,但这是物理变化,不能说它遵守质量守恒定律。
②质量守恒定律指的是“质量守恒”,不包括其他方面的守恒,如对反应物和生成物均是气体的反应来说,反应前后的总质量守恒,但是其体积却不一定守恒。
③质量守恒定律中的第一个“质量”二字,是指“参加”化学反应的反应物的质量,不是所有反应物质量的任意简单相加。
例如,2g氢气与8g氧气在点燃的条件下,并非生成10g水,而是1g氢气与8g氧气参加反应,生成9g水
④很多化学反应中有气体或沉淀生成,因此“生成的各物质质量总和”包括了固态、液态和气态三种状态的物质,不能把生成的特别是逸散到空气中的气态物质计算在“总质量”之外而误认为化学反应不遵循质量守恒定律
质量守恒定律的微观实质:
(1)化学反应的实质在化学反应过程中,参加反应的各物质(反应物) 的原子,重新组合而生成其他物质(生成物)的过程。由分子构成的物质在化学反应中的变化过程可表示为:

(2)质量守恒的原因在化学反应中,反应前后原子的种类没有改变,数目没有增减,原子本身的质量也没有改变,所以,反应前后的质量总和必然相等。例如,水通电分解生成氢气和氧气,从微观角度看:当水分子分解时,生成氢原子和氧原子,每两个氢原子结合成一个氢分子,每两个氧原子结合成一个氧分子。

质量守恒定律的延伸和拓展理解:
质量守恒定律要抓住“六个不变”,“两个一定变”“两个可能变”。
| 六个不变 | 宏观 | 反应前后的总质量不变 |
| 元素的种类不变 | ||
| 元素的质量不变 | ||
| 微观 | 原子的种类不变 | |
| 原子的数目不变 | ||
| 原子的质量不变 |
| 两个一定变 | 物质的种类一定变 |
| 构成物质的分子种类一定变 |
| 两个可能变 | 分子的总数可能变 |
| 元素的化合价可能变 |
如从水电解的微观示意图能得出的信息:
①在化学反应中,分子可以分成原子,原子又重新组合成新的分子;
②一个水分子是由两个氢原子和一个氧原子构成的,或一个氧分子由两个氧原子构成、一个氧分子由两个氢原子构成。或氢气、氧气是单质,水是化合物
③原子是化学变化中的最小粒子。
④水是由氢、氧两种元素组成的。
⑤在化学反应,氧元素的种类不变。
⑥在化学反应中,原子的种类、数目不变。
⑦参加反应的各物质的质量总和等于反应后生成的各物质的质量总和。
质量守恒定律的发现:
1. 早在300多年前,化学家们就对化学反应进行定量研究。1673年,英国化学家波义耳(RobertBoyle, 1627-1691)在一个敞口的容器中加热金属,结果发现反应后容器中物质的质量增加了。
2. 1756年,俄国化学家罗蒙诺索夫把锡放在密闭的容器里锻烧,锡发生变化,生成白色的氧化锡,但容器和容器里物质的总质量,在锻烧前后并没有发生变化。经过反复实验,都得到同样的结果,于是他认为在化学变化中物质的质量是守恒的。
3. 1774年,法国化学家拉瓦锡用精确的定量实验法,在密封容器中研究氧化汞的分解与合成中各物质质量之间的关系,得到的结论是:参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。
4. 后来.人们用先进的测址仪器做了大量精度极高的实验,确认拉瓦易的结论是正确的。从此,质量守恒定律被人们所认识。
质量守恒定律的应用:
(1)解释问题
①解释化学反应的本质—生成新物质,不能产生新元素(揭示伪科学的谎言问题)。
②解释化学反应前后物质的质量变化及用质量差确定某反应物或生成物。
(2)确定反应物或生成物的质量
确定反应物或生成物的质量时首先要遵循参加反应的各种物质的质量总量等于生成的各种物质的质量总和;其次各种物质的质量比等于相对分子质量与化学计量数的乘积之比。
(3)确定物质的元素组成
理解在化学反应前后,元素的种类不发生改变。可通过计算确定具体的元素质量。
(4)确定反应物或生成物的化学式
比较反应前后各种原子个数的多少,找出原子个数的差异。但不能忘记化学式前的化学计量数。
(5)确定某物质的相对分子质量(或相对原子质量)
运用质量守恒定律确定某物质的相对分子质量 (或相对原子质量)时,首先寻找两种已知质量的物质,再根据化学方程式中各物质间的质量成正比即可计算得出。注意观察物质化学式前面的化学计量数。
(6)确定化学反应的类型
判定反应的类型,首先根据质量守恒定律判断反应物、生成物的种类和质量(从数值上看,反应物质量减少,生成物质最增加)。如果是微观示意图,要对比观察减少的粒子和增加的粒子的种类和数目再进行判断。
(7)判断化学方程式是否正确
根据质量守恒定律判断化学方程式的对与否关键是看等号两边的原子总数是否相等,同时注意化学式书写是否有误。
乳化和乳化作用的概念:
1. 乳化现象:
乳浊液不稳定,静置分层,在乳浊液中加人洗涤剂以后,油虽然并没有溶解在水中,但这时形成的乳浊液却能均匀、稳定地存在而不分层,这种现象叫乳化现象。
“乳化”形成的并不是溶液,例如植物油中加入水,加入乳化剂并不是水溶解了油,只是使植物油分散成无数细小的液滴存在于水中而不聚集。
2. 乳浊液:小液滴分散到液体里形成的混合物。
3. 乳化作用:
乳蚀液的稳定剂是一类表面活性剂,阻止小液滴相互凝结。洗涤剂能把植物油分散成无数细小的液滴而不聚集成大的油珠,洗涤剂所起的作用就是乳化作用,使植物油分散成无数细小的液滴存在于水中而不聚集。
用汽油去油污与用洗涤剂洗去油污的不同:
利用汽油和洗涤剂均能除一去油污,但二者除去油污的原理不同。汽油溶解油污时形成溶液,但加了洗涤剂的水清洗油污是把油污分散成细小的液滴,使其形成乳浊液,再随着水漂走。
除去织物上污渍的方法:
乳化作用在生活中的应用:
①洗涤:用乳化剂(洗涤剂)可以将衣服上、餐具上的油污洗掉,如肥皂、洗洁精等。
②农药的使用:在农药中加入一定量的乳化剂后. 再溶解在有机溶剂里,混合均匀制成的透明液体叫乳油。
1. 乳化现象:
乳浊液不稳定,静置分层,在乳浊液中加人洗涤剂以后,油虽然并没有溶解在水中,但这时形成的乳浊液却能均匀、稳定地存在而不分层,这种现象叫乳化现象。
“乳化”形成的并不是溶液,例如植物油中加入水,加入乳化剂并不是水溶解了油,只是使植物油分散成无数细小的液滴存在于水中而不聚集。
2. 乳浊液:小液滴分散到液体里形成的混合物。
3. 乳化作用:
乳蚀液的稳定剂是一类表面活性剂,阻止小液滴相互凝结。洗涤剂能把植物油分散成无数细小的液滴而不聚集成大的油珠,洗涤剂所起的作用就是乳化作用,使植物油分散成无数细小的液滴存在于水中而不聚集。
用汽油去油污与用洗涤剂洗去油污的不同:
利用汽油和洗涤剂均能除一去油污,但二者除去油污的原理不同。汽油溶解油污时形成溶液,但加了洗涤剂的水清洗油污是把油污分散成细小的液滴,使其形成乳浊液,再随着水漂走。
除去织物上污渍的方法:
| 污渍 | 清洗方法 |
| 蓝墨水 | 白色织物上,可用草酸低稀溶液和漂白剂溶液轮流擦拭,再用洗涤剂和水洗;有色织物上,小心用高锰酸钾溶液擦拭,污渍去掉后,迅速用过氧化氢稀溶液擦拭污渍处,并立即用水漂洗 |
| 圆珠笔油 | 用酒精擦拭,再用洗涤剂洗,最后用水洗 |
| 菜汤,乳汁 | 用酒精擦拭,然后用稀氨水揉搓,再用水洗 |
| 水果渍 | 用氯化钠溶液洗,或用草酸稀溶液沾湿,再用水洗;如果是白色织物,可用过氧化氢稀溶液沾湿,再用水洗 |
| 血渍 | 刚沾上时,立即用冷水洗,再用洗涤剂洗,最后用水洗;沾污时间较长的,可用氨水擦拭,片刻后用冷水洗,如不能除净,用草酸稀溶液洗涤,然后用水洗 |
| 铁锈 | 草酸稀溶液清洗,然后用水洗 |
| 沥青 | 用酒精或汽油擦拭多次,然后用水洗 |
乳化作用在生活中的应用:
①洗涤:用乳化剂(洗涤剂)可以将衣服上、餐具上的油污洗掉,如肥皂、洗洁精等。
②农药的使用:在农药中加入一定量的乳化剂后. 再溶解在有机溶剂里,混合均匀制成的透明液体叫乳油。
构成物质的微粒:
分子、原子、离子是构成物质的基本微粒。
分子,原子,离子的比较:
分子和原子的比较:
原子与离子的比较:
分子、原子、离子是构成物质的基本微粒。
分子,原子,离子的比较:
| 分子 | 原子 | 离子 | |
| 概念 | 保持物质化学性质的最小粒子 | 是化学变化中的最小粒子 | 带电的原子或原子团 |
| 表示方法 | 用化学式表示. 如H2,He | 用元素符号表示,如H,Fe | 用离子符号表示,如Na+、NO3- |
| 微粒的运动 | 物理变化是分子运动的结果,如:水的蒸发 | 化学变化是原子运动的结果. 如:水的电解 | 离子运动的结果可能是物理变化。也可能是化学变化,如:NaCl的溶解是物理变化, NaCl与AgNO3反应是化学变化 |
| 化学计量数与符号的关系 | 化学式、元素符号、离子符号前加上化学计量数,如2H,2H2,3Na+,只表示原子、分子、离了的“个数”,不表示元素和物质 | ||
| 联系 |  | ||
分子和原子的比较:
| 原子 | 分子 | |
| 定义 | 化学变化中的最小粒子 | 保持物质(由分子直接构成的物质)化学性质的最小粒子 |
| 相同点 | ①都是构成物质的基本粒子,有些物质是由分子构成的.有些物质是由原子直接构成的; ②都很小,但者阶一定的体积和质量; ③都在不断地运动; ④微粒子间都有间隔; ⑤都能保持物质的化学性质 | |
| 区别 | 化学变化中不能再分 | 化学变化中可以再分 |
| 如:在电解水实验中,水分子可以分成氢原子和氧原子,而氢原子和氧原子不可以再分,只是重新组合成氢分子、氧分子 | ||
| 同种原子具有相同的质子数 | 同种分子化学性质相同 | |
| 联系 |  | |
原子与离子的比较:
| 原子 | 离子 | |
| 概念 | 化学变化中最小粒子 | 带电荷的原子或原子团 |
| 电性 | 呈电中性,不带电 | 带电: 阳离子带正电 阴离子带负电 |
| 表示方法 | 用元素符号表示;Na 表示钠原子,2Na表示2个钠原子 | 在元素符号右上角先写电荷数,后标出电性 (+、-):Na+表示钠离子,2Na+表示2个钠离子 |
| 数量关系 | 核内质子数=核外电子数 | 阳离子:核内质子数> 核外电子数 阴离子:核内质子数< 核外电子数 |
| 相似点 | 都是构成物质的一种粒子 | |
| 转化 |  | |
发现相似题
与“对一些生活中的事实解释合理的是( )A.纸张燃烧后,余烬质...”考查相似的试题有:
- A、B、C三种物质各15 g,它们化合时只能生成30 g新物质D.若增加10 g A,则反应停止后,原反应物中只余C.根据上述条件推断下...
- 二氧化氯(ClO2)已被世界卫生组织确认为一种安全、高效、广谱的强力杀菌剂,二氧化氯的制取可通过下列反应完成:2NaClO3+4HCl(...
- 海水中蕴含80多种元素,是一个巨大的宝藏。(1)海水晒盐是利用 (填“蒸发结晶”或“冷却结晶”)的方法。(2)镁合金的强度高、...
- 学习了有关物质的溶解知识后,佳伟同学在家中厨房里把下列物质与水混合,不能形成溶液的是A.食盐B.色拉油C.白醋D.白糖
- 安比先是一种常见的消炎药品,其主要成分氨苄西林的化学式为C16H19N3O4S•3H2O,其中含有______种元素,一个分子中共有______...
- 从微粒观角度认识物质的构成和变化是化学学习的重要内容.你认为下列各现象的微观解释正确的是( )A.气体易被压缩,是因为...
- 1911年著名物理学家卢瑟福等人为探索原子的内部结构进行了下面的实验.他们用一束带正电的、质量比电子大得多的高速运动的α粒...
- 下列各种物质中,由原子直接构成的是[ ]A.氮气B.铁C.甲烷气体D.二氧化硫气体
- 人们常说“墙内开花墙外香”。这句话的科学本意揭示了A.分子间有间隙B.分子的质量和体积都很小C.分子总是在不断运动着D.分...
- (1)列举几种常见的空气污染物______、______、______.(2)构成物质的粒子有______、______、______等.如二氧化碳是由___...