本试题 “人类生存离不开氧气,所以学习有关氧气的知识很重要。(1)根据下列有关氧气的实验,回答问题。①在实验A中,利用红磷燃烧消耗瓶内的氧气,使瓶内压强减小,烧杯...” 主要考查您对氧气的制取和收集
电解水实验
空气中氧气含量的测定
S,Fe,C,P等物质在氧气中的燃烧
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 氧气的制取和收集
- 电解水实验
- 空气中氧气含量的测定
- S,Fe,C,P等物质在氧气中的燃烧
氧气的制取是初中化学的重点,也是历年中考的热点。我们不仅要学好氧气制取的知识,而且要触类旁通,逐步掌握实验室制取气体的一般思路和方法。中考对制取氧气的考查主要集中在药品选用、实验装置、操作步骤等方面。
实验室制取收集氧气:
| 过氧化氢制氧气 | 高锰酸钾制氧气 | |
| 药品和反应原理 | 2H2O2 2H2O+O2↑ 2H2O+O2↑ |
2KMnO4 K2MnO4 + MnO2 + O2↑ K2MnO4 + MnO2 + O2↑ |
| 发生装置 | 固液常温型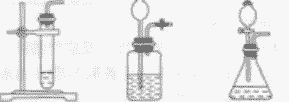 |
固体加热型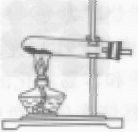 |
| 收集装置 | 氧气可用排水法收集,也可用向上排空气法收集 | |
| 整体装置图 |  |
 |
| 操作步骤 | ①检查装置气密性 ②再锥形瓶中装入二氧化锰 ③塞好带有长颈漏斗和导管的橡皮塞(长颈漏斗的下端一定在液面以下,否则氧气会从长颈漏斗中跑出来) ④向长颈漏斗中加入过氧化氢溶液 ⑤收集氧气 |
①检查装置气密性 ②将药品平铺在试管底部,用带导管的单孔橡皮塞塞紧试管口(用高锰酸钾制取氧气,还要在管口放一小团棉花) ③将试管固定在铁架台上 ④点燃酒精灯,预热后加热试管 ⑤当导管口有连续均匀的气泡冒出时开始收集气体 ⑥收集完毕,先将导管移出水面 ⑦熄灭酒精灯。加热高锰酸钾(或氯酸钾和二氧化锰的混合物)制氧气,用排水法收集,其操作步骤可概括为:“查”“装”“定”“点”“收”“离”“熄”7个字。可用谐音记忆为“茶庄定点收利息”。 |
| 注意事项 | ①伸入试管或锥形瓶中的导管应刚刚露出橡皮塞即可,否则不利于气体的导出。 ②用排水法收集氧气时,导管应刚伸人集气瓶口即可,过长不利于水的排出,气体不易收集满。 ③用向上排空气法收集氧气时,导管要伸入集气瓶的底部,否则不利于空气的排出,收集的气体不纯。 ④用长颈漏斗时,长颈漏斗末端应在液面以下,否则氧气会从长颈漏斗中逸出。 |
①药品要平铺在试管底部,均匀受热。 ②试管口要略向下倾斜,防止药品中湿存的水分受热后变成水蒸气,遇冷凝结成水倒流回试管底部,使试管炸裂。 ③铁架台的铁夹要夹在试管的中上部(或距离试管口1/3处)。 ④试管内的导管稍伸出橡皮塞即可,这样便于气体导出。 ⑤集气瓶充满水后倒放入水槽中(瓶口要在水面下)。 ⑥加热时要先使试管均匀受热,然后酒精灯外焰要对准药品所在部位加热。 ⑦用排水法收集气体时,应注意当气泡连续均匀冒出时再收集,否则收集的气体中混有空气,当集气瓶口有大盆气泡冒出时,证明已集满。 ⑧停止加热时,应先把导管从水里撤出,再撤掉酒精灯。如果先熄灭酒精灯,试管内气体温度降低,压强减小,水槽中的水就会被倒吸入热的试管内,使试管炸裂。 ⑨用高锰酸钾制氧气时,试管口要放一小团棉花,防止加热时高锰酸钾小颗粒进人导管。 ⑩盛氧气的集气瓶应盖上玻璃片正放,因为在相同状况下氧气的密度大于空气的密度,正放可减少气体的逸散。 |
电解就是将两根金属或碳棒(即电极)放在要分解的物质(电解质)中,然后接上电源,使电流通过液体。化合物的阳离子移到带负电的电极(阴极),阴离子移到带正电的电极(阳极),化合物分为二极。
电解过程
用电使化合物分解的过程就叫电解过程。
水(H2O)被电解生成电解水。电流通过水(H2O)时,氢气在阴极形成,氧气则在阳极形成。带正电荷的离子向阴极移动,溶于水中的矿物质钙、镁、钾、钠……带正电荷的离子,便在阴极形成,就是我们所喝的碱性水;而带负电的离子,在阴极生成。
电解水实验:
1.实验装置图:
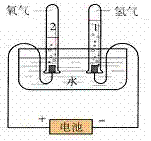
2.表达式:
水
 氢气+氧气
氢气+氧气2H2O
 2H2↑+O2↑
2H2↑+O2↑3.实验现象:
(1)通电后两电极上都有气泡产生;
(2)与电源正极相连接的一端产生的气体比连接负极一端产生的气体少,
接负极一端玻璃管中气体的体积是接正极一端玻璃管内气体体积的2倍。
4.产物检验
(1)正极一端的气体能使带火星的木条复燃,证明气体是氧气。
(2)负极一端的气体能燃烧,并看到微弱的淡蓝色火焰(或听到爆鸣声),
证明气体是氢气。
5.实验结论:
(1)水是由氢元素和氧元素组成的。
(2)1个水分子由2个氢原子和1个氧原子构成。
(3)化学变化中,分子可以再分,原子不可以再分。
6.注意事项:
(1)实验前在水中加入少量的氢氧化钠或者稀硫酸,可增强水的导电性,
加快反应速率。
(2)实验开始时产生的氧气和氢气的体积会小于1:2,是因为氢气难溶于水,
氧气不易溶于水,开始产生的氧气有一部分溶于水,实验时间越长,
其比值越接近1:2。
电解水记忆口诀:
水中通入直流电,正氧负氢会出现;氢二氧一体积比,任何时候都不变。
空气中氧气含量的测定实验是初中化学的一个重要实验,同时也是历年各地中考命题的热点。近年来在课本实验的基础上进行拓展、创新,旨在考查同学们的实验探究能力及创新思维能力已成为中考命题的趋势。
空气中氧气含量的测定实验:
| 原理 | 利用红磷在空气中燃烧,将瓶内氧气消耗掉,生成五氧化二磷固体,使空气内压强减少,在大气压作用下,进入容器内水的体积即为减少的氧气的体积。4P + 5O2 2P2O5 2P2O5 |
| 装置 | 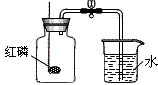 |
| 步骤 | ①连接装置,检查装置气密性 ②把集气瓶的容积分成5等份,做好记号。 ③用止水夹夹紧胶管。 ④在燃烧匙内放入过量的红磷。 ⑤点燃燃烧匙中的红磷,立即伸入集气瓶中,把塞子塞紧 ⑥待红磷熄灭并冷却后,打开止水阀 |
| 现象 | ①集气瓶中有大量的白烟生成,并放出热量 ②打开止水夹,烧杯中的水倒流到集气瓶中,并上升到约1/5处 |
| 结论 | 空气中氧气的体积分数约为1/5。 |
实验中的注意事项:
1.测定空气中氧气的体积分数时,所用物质应满足的条件:
①此物质能够在空气中中燃烧,不能用铁丝代替,铁丝在空气中不能燃烧
②此物质在空气中燃烧的时只能消耗氧气,不能消耗其他气体。不能选用镁代替红磷,因为镁不仅与空气中的氧气反应,还和二氧化碳反应。
③此物质在空气中燃烧时只能生成固体,而不能生成气体,一般不用木炭,硫代替红磷。
2.实验失败与成功的原因:
①装置不漏气是本实验成功的关键,所以实验前应检查装置的气密性。如果气密性不好,外界空气会进入容器,使测定结果低于1/5。
②实验中红磷要过量,以消耗容器内全部氧气,否则会使测定结果低于1/5.
③实验完毕,待容器冷却至室温后,再打开止水夹,观察进水的体积,避免因温度高,气体膨胀,使测定结果低于1/5.
空气中氧气含量测定实验的改进:
1.测定原理:
(1)红磷(白磷)在密闭的容器中燃烧,消耗氧气,生成白色固体五氧化二磷。密闭容器内压强减小,大气压将水压入容器,通过测定容器中的水的量测定氧气在空气中的含量。
(2)利用金属与氧气反应,消耗密闭容器中的氧气使密闭容器内压强减小,在大气压的作用下,推动刻度器上的活塞移动,测出氧气体积。
2.装置
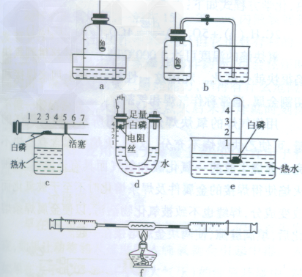
3.实验现象
(1)红磷(白磷)燃烧,产生大量白烟
(2)a中睡眠上升约占钟罩内空气体积的1/5
b中进入集气瓶中水的体积约占集气瓶液面以上容积的1/5
c中活塞移动到4处
d中U形管左侧液面上升至刻度1处
e中试管中液面上升至刻度1处
f中右侧的活塞会左移
4.结论
空气中氧气体积约占空气总体积的1/5
5.注意事项
(1)实验中红磷要过量,以消耗容器内全部氧气,否则会使测定结果低于1/5.
(2)装置不漏气是本实验成功的关键,所以实验前应检查装置的气密性。如果气密性不好,外界空气会进入容器,使测定结果低于1/5。
(3)不能用硫、木炭、铁丝等代替红磷(白磷)。因为硫或木炭燃烧后产生的气体会弥补反应所消耗的氧气,导致测得的体积不准确,而细铁丝在空气中难以燃烧,氧气体积几乎不变,因此密闭空气内水面不上升。
(4)导气管要夹紧,燃烧匙放入集气瓶时要迅速,防止空气受热膨胀,从导气管或集气瓶逸出,导致进入水的体积增多,使实验结果偏高。
氧化的化学性质很活泼,很多物质都能与氧气发生化学反应。
部分物质在空气中和氧气中反应的对比:
a)碳和氧气反应
方程式:C + O2 CO2
CO2
现象:剧烈燃烧,发白光,放热,生成使澄清石灰水变浑浊的气体
b)硫和氧气反应
方程式:S + O2 SO2
SO2
现象:发出明亮的蓝紫色火焰,放热,生成有刺激性气味的气体
注意:实验前应在瓶底放少量水,用来吸收生成的有毒气体。
c)红磷和氧气反应:
方程式:4P + 5O2 2P2O5
2P2O5
现象:发出耀眼的白光,放热,生成大量白烟
生成的P2O5是固体小颗粒,现象为白烟,不是白雾。
d)铁和氧气的反应:
方程式:3Fe + 2O2 Fe3O4
Fe3O4
现象:剧烈燃烧,火星四射,放出热量,生成黑色物质
注意:集气瓶底放一层细沙或少量水。
e)镁和氧气反应:
方程式:2Mg + O2 2MgO
2MgO
现象:剧烈燃烧,发出耀眼的白光,放出热量,生成白色粉末状固体,有白烟。
注意:不能手持镁条,应用坩埚钳夹持。
f)石蜡和氧气反应
文字表达式:石蜡+氧气 水+二氧化碳
水+二氧化碳
现象:剧烈燃烧,放出热量,发出白光,如果在火焰上方罩一个干冷烧杯,
烧杯内壁有水珠,生成使澄清石灰水变浑浊的气体。
烟和雾的区别:
a)烟:大量固体小颗粒分散在空气长产生烟。红磷燃烧产生大量白烟,是燃烧生成的固体P2O5分散在空气中形成的
b)雾:大量小液滴分散在气体中产生雾。打开盛浓盐酸的瓶塞,瓶口有白雾,是挥发的HCl气体遇到空气中的水蒸气形成了盐酸小液滴。
a)光:固体物质燃烧使发光。镁条燃烧发出耀眼的强光,木炭在氧气中燃烧产生白光
b)气体物质和容易气化的物质燃烧时产生火焰。蜡烛在氧气中燃烧产生白色的火焰,是石蜡熔化后生成的气体燃烧而产生的。
描述物质在氧气中燃烧的现象的技巧:
可按三个顺序从三个方面进行:
(1)剧烈燃烧,有什么颜色的光,火焰;
(2)放热;
(3)生成物的特性
与“人类生存离不开氧气,所以学习有关氧气的知识很重要。(1)根据...”考查相似的试题有:
- 化学是一门以实验为基础的学科,化学所取得的丰硕成果,是与实验的重要作用分不开的。结合下列实验装置图回答问题:(1)写出...
- 下列各图是九年级化学中常见的几个实验操作或实验装置,其中正确的是(A.实验室制取氧气B.气体通过洗气瓶C.收集CO2气体D....
- 如图是实验室常用的装置,请据图回答:(1)写出仪器①的名称 。在实验室收集二氧化碳气体一般只用D装置,由此推测二氧化碳气...
- (5分)右图是某同学设计的趣味实验装置,其气密性良好。操作时,打开A中的分液漏斗的活塞,放出部分溶液后,立即关闭活塞。...
- 在碳、一氧化碳、二氧化碳、氧气四种物质中,每一种物质都有不同于其他三种物质的特点,例如:碳:_______________________。...
- 下图是化学实验室制取气体的常用装置。(1)写出图中标号仪器的名称:①_________,②_________。(2)以下六种物质是初中教材中出...
- 图中的四个图象分别代表对应的四个实验过程,其中正确的是( )A.分别加热等质量的氯酸钾与高锰酸钾B.向足量的稀硫酸中逐渐...
- 用来测定空气成分的方法很多,图1所示的是小明用红磷在空气中燃烧来测定氧气在空气中含量的方法。实验过程是:第一步:将集气...
- 用墨书写或绘制的字画能够保存很长时间而不褪色 ,这一事实说明了在常温下碳的化学性质 。
- 能与无色硝酸银溶液反应,使溶液变为蓝色的金属是( )A.铝B.铁C.铜D.银