本试题 “2009年“六·五”世界环境日,中国主题是“减少污染--行动起来”,这向世界传达了建设环境友好型社会的理念。已知反应:①②请回答下列问题(1)反应①的熵变S_______...” 主要考查您对碳单质及化合物
熵;熵变
燃烧热
化学反应热的计算
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 碳单质及化合物
- 熵;熵变
- 燃烧热
- 化学反应热的计算
碳:
①元素符号:C
②原子结构示意图: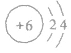
③电子式: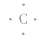
④周期表中位置:第二周期ⅣA族
⑤含量与存在:在地壳中的含量为0.087%,在自然界中既有游离态,又有化合态
⑥同素异形体:金刚石、石墨、C60、活性炭
碳(活性炭):
①金刚石:纯净的金刚石是无色透明、正八面体形状的固体,硬度大,熔点高,不导电,不溶于水
石墨:深灰色的鳞片状固体,硬度小,质软,有滑腻感,熔点高,具有导电性
活性炭:黑色粉末状或颗粒状的无定形碳,疏松多孔,有吸附性
②碳的化学性质:
a.稳定性:在常温下碳的化学性质稳定,点燃或高温的条件下能发生化学反应
b.可燃性:氧气充足的条件下:C+O2 CO2 氧气不充分的条件下:2C+O2
CO2 氧气不充分的条件下:2C+O2 2CO
2CO
c.还原性:
木炭还原氧化铜:C+2CuO 2Cu+CO2↑
2Cu+CO2↑
焦炭还原氧化铁:3C+2Fe2O3 4Fe+3CO2↑
4Fe+3CO2↑
焦炭还原四氧化三铁:2C+Fe3O4 3Fe+2CO2↑
3Fe+2CO2↑
木炭与二氧化碳的反应:C+CO2 CO
CO
二氧化碳:
①物理性质:常温下,二氧化碳是一种无色无味的气体,密度比空气大,能溶于水。固态的二氧化碳叫做干冰。
②化学性质:
a.一般情况下,二氧化碳不能燃烧,也不支持燃烧,不供给呼吸,因此当我们进入干枯的深井,深洞或久未开启的菜窖时,应先做一个灯火实验,以防止二氧化碳浓度过高而造成危险
b.二氧化碳和水反应生成碳酸,使紫色石蕊试液变红:CO2+H2O===H2CO3,碳酸不稳定,很容易分解成水和二氧化碳,所以红色石蕊试液又变回紫色:H2CO3===H2O+CO2↑
c.二氧化碳和石灰水反应:Ca(OH)2+CO2====CaCO3↓+H2O
d.二氧化碳可促进植物的光合作用:6CO2+6H2O C6H12O6+6O2
C6H12O6+6O2
③用途:
a.二氧化碳不支持燃烧,不能燃烧,比空气重,可用于灭火
b.干冰升华时吸收大量的热,可用它做制冷剂或人工降雨
c.工业制纯碱和尿素,是一种重要的化工原料 d.植物光合作用,绿色植物吸收太阳能,利用二氧化碳和水,合成有机物放出氧气。
一氧化碳:
①物理性质:通常状况下,是一种没有颜色,气味的气体,比空气略轻难溶于水。
②化学性质
a.可燃性:2CO+O2 2CO2
2CO2
b.还原性:一氧化碳还原氧化铜:CO+CuO Cu+CO2 一氧化碳还原氧化铁:3CO+Fe2O3
Cu+CO2 一氧化碳还原氧化铁:3CO+Fe2O3 2Fe+3CO2 一氧化碳还原四氧化三铁:4CO+Fe3O4
2Fe+3CO2 一氧化碳还原四氧化三铁:4CO+Fe3O4 3Fe+4CO2
3Fe+4CO2
c.毒性:一氧化碳能与人体血液中的血红蛋白结合,使血红蛋白失去运输氧气的能力,造成机体缺氧。冬天用煤火取暖,如排气不良,就会发生煤气中毒,就CO中毒。CO重要来源是汽车尾气和煤,石油等含碳燃料的不完全燃烧。
③用途:用作燃料,冶炼金属。 ④碳酸:弱酸,不稳定,易分解H2CO3==CO2↑+H2O
碳酸盐:
1.正盐与酸式盐的比较
| 正盐 | 酸式盐 | |
| 水溶性 | 除K、Na、铵的碳酸盐易溶于水外,其余都难溶于水 | 都溶于水 |
| 热稳定性 | 较稳定 ①K2CO3、Na2CO3等碱金属的正盐受热难分解 ②CaCO3、(NH4)2CO3 等受热易分解 |
受热易分解 2NaHCO3  Na2CO3+ H2O+CO2↑ Na2CO3+ H2O+CO2↑Ca(HCO3)2  CaCO3+H2O+CO2↑ CaCO3+H2O+CO2↑ |
| 与酸反应 | CO32-+2H+== CO2↑+H2O CaCO3+2H+=Ca2+ +H2O+CO2↑ |
HCO3-+H+==H2O+ CO2↑(相同条件下,NaHCO3与酸反应放出CO2的速率比Na2CO3快) |
| 与碱反应 | Na2CO3+Ca(OH)2 ==CaCO3↓+2NaOH | NaHCO3+NaOH==Na2CO3+H2O Ca(HCO3)2+Ca(OH)2==2CaCO3↓+2H2O |
| 转化关系 |  | |
(1)在水中的溶解性:一般地,相同温度下,难溶性正盐的溶解度小于其酸式盐,可(易)溶性正盐的溶解度大于其酸式盐。如CaCO3,难溶于水,Ca(HCO3)2易溶于水;Na2CO3易溶于水,NaHCO3的溶解度比 Na2CO3的小。
(2)与酸或碱反应:强酸的酸式盐只与碱反应而不与酸反应;弱酸的酸式盐与足量强碱反应生成正盐,与足量强酸反应生成弱酸。
(3)热稳定性:一般地,热稳定性的大小顺序为正盐>酸式盐(盐的阳离子相同,成盐的酸相同)。
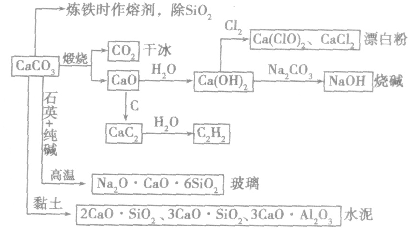
3.碳酸钙在自然界中存在广泛,是岩石的主要成分之一。不溶于水,但溶于酸。大理石、石灰石的主要成分是CaCO3,它们既是重要的化工原料,又是重要的建筑材料。其用途图示如下:
CO2气体与溶液的反应规律:
1.向某溶液中不断通入CO2气体至过量时,现象是“先产生白色沉淀,后沉淀逐渐溶解”
(1)向澄清石灰水中不断通入CO2气体的反应为:
Ca(OH)2+CO2==CaCO3↓+H2O
CaCO3+CO3+H3O==Ca(HCO3)2
(2)向氧氧化钡溶液中不断通入CO2气体的反应为:
Ba(OH)2+CO2==BaCO3↓+H2O
BaCO3+CO2+H2O==Ba(HCO3)2
(3)向漂白粉溶液中不断通入CO2气体的反应为:
Ca(ClO)2+CO2+H2O==CaCO3↓+2HClO
CaCO3+CO2+H2O==Ca(HCO3)2
2.向某溶液中不断通入CO2气体至过量时,现象为“产生白色沉淀或浑浊,沉淀或浑浊不消失”
(1)在NaAlO2溶液中不断通入CO2气体至过量时,反应为:
2AlO2-+CO2(少量)+3H2O==2Al(OH)3↓ +CO32-
2AlO2-+CO2(过量)+2H2O==Al(OH)3↓ +HCO3-
(2)向Na2SiO3溶液中不断通入CO2气体至过量时,反应为:
SiO32-+CO2+H2O==H2SiO3↓+CO32-
SiO32-+2CO2+2H2O==H2SiO3↓+2HCO3-
(3)向饱和Na2CO3溶液中不断通入CO2气体,反应为:
2Na++CO32-+CO2+H2O==2NaHCO3↓
3.CO2与NaOH溶液反应后,溶液中溶质的判断将CO2气体逐渐通入NaOH溶液中,先后发生化学反应:
①CO2+2NaOH==Na2CO3+H2O
②CO2+Na2CO3+H2O==2NaHCO3
向一定量的NaOH溶液中通入CO2气体后,溶液中溶质的成分要根据NaOH与CO2的物质的量之比进行讨论。
当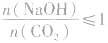 时,发生反应①和②,溶液中的溶质为NaHCO3;
时,发生反应①和②,溶液中的溶质为NaHCO3;
当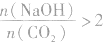 时,发生反应①,溶液中的溶质为 Na2CO3和NaOH;
时,发生反应①,溶液中的溶质为 Na2CO3和NaOH;
当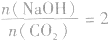 时,发生反应①,溶液中的溶质为Na2CO3;
时,发生反应①,溶液中的溶质为Na2CO3;
当 时,发生反应①和②,溶液中为Na2CO3和NaHCO3
时,发生反应①和②,溶液中为Na2CO3和NaHCO3
碳酸氢盐与碱反应的规律及CO32- HCO3-的鉴别方法:
1.酸式盐与碱反应时的产物要根据相对用量判断
如Ca(HCO3)2溶液中滴加NaOH溶液:
Ca(HCO3)2+NaOH==CaCO3↓+NaHCO3+ H2O(NaOH少量)
Ca(HCO2)2+2NaOH==CaCO3↓+Na2CO3+ 2H2O(NaOH过量)
2.CO32-和HCO3-的鉴别
(1)利用正盐和酸式盐的溶解性可区别CO32-和HCO3-,如分别和BaCl2溶液反应,生成的BaCO3不溶,生成的Ba(HCO3)2易溶;
(2)利用与H+反应产生CO2的快慢检验CO32-或HCO3-
碳族元素:
1.在元素周期表中的位置及结构碳旌死素位于第ⅣA族,包括碳(C)、硅(Si)、锗(Ge)、锡(Sn)、铅(Pb)五种元素。最外层皆有4个电子,这种结构不易得电子也不易失电子,易形成共价键,难形成离子键。
2.主要化合价碳族元素的化合价主要有+2和+4,C、Si、Ge、Sn的+4价化合物较稳定,而Pb的+2价化合物较稳定。
3.氢化物、最高价氧化物及其对应的水化物
氢化物:
最高价氧化物:RO2;
最高价氧化物对应的水化物为H2RO3、 H4RO4或R(OH)4
4.碳族元素的金属性与非金属性的递变规律由C至Pb,核电荷数逐渐增多,原子半径逐渐增大,原子核对最外层电子的吸引能力逐渐减小,失电子能力逐渐增强,得电子能力逐渐减弱,非金属性逐渐减弱,金属性逐渐增强。由碳族元素形成的单质中,碳、硅为非金属,但硅有金属光泽;锗、锡、铅为金属。
在一定温度和压强下,无需外界帮助就能自动进行的过程叫做自发过程;在一定温度和压强下,无需外界帮助就可以自发进行到显著程度的化学反应叫自发反应。
化学反应方向的判据:
1.焓变对反应方向的影响:
△H<0 的化学反应也能自发进行。但有些△H>0的化学反应也能自发进行,也就是说,焓变是与化学反应能否自发进行有关的一个重要因素,但不是唯一的因素:
2.熵与熵变:
熵是用于描述体系混乱度的物理量,以符号S表示。熵值越大,体系的混乱度越大。
在一定条件下,不同物质的熵值不同;对同一物质来说,S(g)>S(l)>S(s),S(aq)>S(s)。
物质发生化学反应后熵值也发生变化,这个熵值的变化叫做反应的熵变,以符号△S表示,单位是
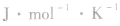 。
。△S=生成物总熵一反应物总熵
若△S为正值,表示反应过程中熵值增大,称为熵增过程;若△S为负值,表示反应过程中熵值减小,称为熵减过程。在与外界隔离的体系中,自发过程将导致体系的熵值增大,这个原理也叫做熵增原理。
3.熵变对反应方向的影响:
△S>0有利于化学反应的自发进行,有些△S>0 的化学反应在常温下不能自发进行,但在较高温度下可以自发进行,有些△S<0的化学反应也能自发进行。总之,熵变是与化学反应能否自发进行有关的一个重要因素,但不是唯一的因素。
4.焓变与熵变对反应方向的共同影响:
在温度和压强一定的条件下,化学反应的方向是反应的焓变和熵变共同影响的结果,反应方向的判据是
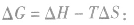
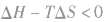 反应能自发进行
反应能自发进行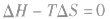 反应达到平衡状态
反应达到平衡状态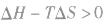 反应不能自发进行
反应不能自发进行在101kPa时,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热。单位为kJ/mol
燃烧热和中和热的异同:
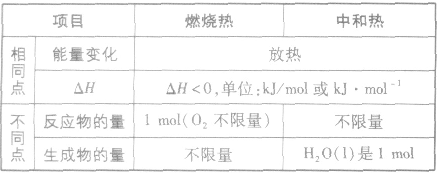
注意事项:
(1)规定是在101kPa 下测出的热量。书中提供的燃烧热数据都是在25℃、101kPa下测定出来的
(2)规定可燃物的物质的量为1mol(这样才有可比性)。因此,表示可燃物的燃烧热的热化学方程式中,可燃物的化学计量数为1,其他物质的化学计量数常出现分数
(3)规定生成稳定的氧化物,例如
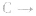
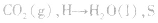
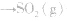 等
等 (4)叙述燃烧热时、不用“+”“-”,在热化学方程式中用△H表示时取“-”
用盖斯定律结合已知反应的反应热求解一些相关反应的反应热时,其关键是设计出合理的反应过程,将已知热化学方程式进行适当数学运算得未知反应的方程式及反应热,使用盖斯定律时应注意以下问题:
(1)当反应方程式乘以或除以某数时,△H也应乘以或除以某数。
(2)反应方程式进行加减运算时,△H也同样要进行加减运算,且要带“+”“-”符号,即把△H看做一个整体进行运算
(3)通过盖斯定律计算并比较反应热的大小时,同样要把△H看做一个整体
(4)在设计的反应过程中常会遇到同一物质固、液、气三态的相互互转化,状态由固→液→气变化时。会吸热;反之会放热
(5)当设计的反应逆向进行时,其反应热与正反应的反应热数值相等,符号相反。
反应焓变(反应热)的简单计算:
1.根据热化学方程式计算焓变与参加反应的各物质的物质的量成正比。
2.根据反应物和生成物的能量计算
△H生成物的能量总和一反应物的能量总和。
3.根据反应物和生成物的键能计算
△H反应物的总键能-生成物的总踺能。
4.根据盖斯定律计算
将两个或两个以上的热化学方程式进行适当的数学运算,以求得所求反应的反应热。
5.根据比热公式进行计算
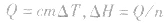
6.反应焓变的大小比较在比较两个热化学方程式中,△H的大小时要带 “+”“-”,比较反应放出或吸收的热量多少时要去掉 “+”“-” .
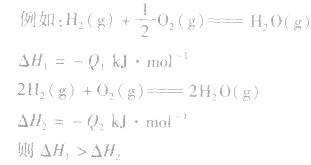
1molH2完全燃烧生成气态水时放出的热量Q1小于2molH完全燃烧生成气态水时放出的热量Q2,即
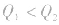 .
.与“2009年“六·五”世界环境日,中国主题是“减少污染--行动起来”,...”考查相似的试题有:
- 下列酸中,属于强酸的是A.硝酸B.盐酸C.硫酸D.高氯酸(分子式为HClO4)
- 传统的硅酸盐工业产品有:玻璃、水泥、陶瓷。在实验室进行物质分离提纯操作实验时,使用的实验仪器大多属于硅酸盐质仪器。下...
- 硅是构成无机非金属材料的一种主要元素,下列有关硅的化合物的叙述错误的是( )。A.氮化硅陶瓷是一种新型无机非金属材料,其...
- 下列说法正确的是A.SiO2不与HNO3、H2SO4等所有酸反应B.CO2和SiO2的对应水化物都是酸,其酸性碳酸比硅酸弱C.CO2与SiO2均是...
- 20世纪80年代人们发现和证实了碳的另一类单质,它们是一系列由偶数个碳原子组成的分子,其中C60(足球烯,分子中含有30个双键...
- 下列有关描述中不正确的是( )A.在所有氧化还原反应中,氧化剂的氧化性一定强于氧化产物的氧化性B.反应A(g)+3B(g)⇌2C...
- 下列有关化学反应方向的描述中正确的是( ) A.任何能使焓减小的过程都能自发进行 B.自发反应一定是熵增加,非自发反应一定...
- 下列叙述正确的是A.吸热反应一定需要加热才能发生,放热反应不需要从外界吸收任何能量就能发生B.伴有能量变化的物质变化都...
- (13分)材料1.某温度时,在2L密闭容器中有X、Y、Z三种气态物质。实验测得不同时刻各物质的量如下表所示,同时测得至3min时吸...
- 国际石油价格多次上涨,为解决能源危机,现在全面推广使用乙醇汽油作为发动机燃料,即在汽油中掺入一定比例的乙醇,以代替一...