本试题 “强酸和强碱稀溶液的中和热表示为H+(aq)+OH-(aq)=H2O(l) △H= -57. 3kJ·mol-1已知:①HCl(aq) +NH3·H2O(aq)=NH4Cl(aq)+H2O(l) △H=-akJ·mol-1②HCl(aq) +NaOH( s)=...” 主要考查您对中和热
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 中和热
中和热:
在稀溶液中,酸和碱发生中和反应生成1molH2O时的反应热。中和热的表示方法: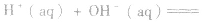
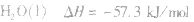
在稀溶液中,酸和碱发生中和反应生成1molH2O时的反应热。中和热的表示方法:
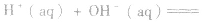
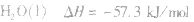
影响中和热测定的因素:
中和反应巾放出的热量为(m1+m1)·c·(t1-t2),其巾溶液的比热容c是已知的,对于给定的反应物的质量m1和m2也是定值,这样求算出的中和热是否接近 57.3kl·mol-1,取决于溶液温度的变化。
在整个实验过程中应把好两关:①隔热关。如:小烧杯周围的泡沫塑料要填满;盖板上两孔只要正好使温度计和环形玻璃搅拌棒通过即可;倒人NaOH溶液要迅速等,尽可能减少实验过程中热量的散失。②准确关。如:配制溶液的浓度要准;NaOH溶液要新制,因为久置的NaOH溶液可能变质导致浓度不准;量取液体体积时读数要准;对溶液温度要读到最高点。
注意事项:
(1)这里的溶液一般要求是稀溶液,这是因为浓酸溶液和浓碱溶液相互稀释时会放出热量
(2)强酸与强碱的反应实质是H+和OH-反应(即与酸、碱的种类无关),通过多次实验测定,1molH+和1molOH-反应生成lmol H2O(l)时,放出的热量为 57.3kJ
(3)中和热是以生成1molH2O为基准的,因此表示中和热的热化学方程式中,水的化学计量数为1,酸、碱的化学计量数可以为分数
发现相似题
与“强酸和强碱稀溶液的中和热表示为H+(aq)+OH-(aq)=H2O(l) △H= -...”考查相似的试题有:
- 某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5的悬浮颗粒物),其主要来源为燃煤、机动车尾...
- 二甲醚是—种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚...
- 有三个热化学方程式:① 2H2(g) + O2(g) = 2H2O (g) ,放出 Q1kJ的热量;② 2 H2(g) + O2(g) =" 2" H2O (l) ,放出Q2kJ的热量;...
- (8分)已知下列两个热化学方程式:2H2(g)+O2(g) ===2H2O(l) △H=-571.6 kJ•mol-1C3H8(g)+5O2(g) ===3CO2(g)+4 H2O(l) △H=-2...
- 家用液化气的主要成分之一是丁烷,试写出表示丁烷燃烧热的热化学方程式:(查阅资料:丁烷的燃烧热为---2900kJ/mol。)(1) ...
- 下列各项表述正确的是[ ]A.次氯酸的电子式: B.表示中和热的热化学方程式:NaOH(aq)+HF(aq)= NaF(aq)+H2O(l) △H=-57.3 kJ/mol...
- (14分)随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。(1...
- 已知在1×105 Pa,298 K条件下,4 g 氢气燃烧生成液态水放出572 kJ热量,下列表示氢气燃烧的热化学方程式的是A.H2O(g) = H2(g)...
- 下列说法正确的是( )A.若反应X+Y=M是放热反应,该反应一定不用加热B.需要加热方能发生的反应一定是吸热反应C.CO2与CaO化...
- 已知H—H键的键能为436kJ/mol,N—H键的键能为391kJ/mol,根据热化学方程式:N2+3H2=2NH3△H ="-" 92.4 kJ/mol可得N≡N键的键能是...