本试题 “铁单质及其化合物在生活、生产中应用广泛。请回答:(1)钢铁在空气中发生吸氧腐蚀时,正极的电极反应是_____________ 。(2)由于氧化性Fe3+>Cu2+,氯化铁溶...” 主要考查您对单质铁
四氧化三铁
铁盐(三价铁离子)
金属的电化学腐蚀
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 单质铁
- 四氧化三铁
- 铁盐(三价铁离子)
- 金属的电化学腐蚀
铁元素:
在元素周期表中的位置:铁的原子序数26,位于周期表中第四周期,第Ⅷ族。
(1)物理性质:银白色、有金属光泽,密度较大,熔点较高,硬度较小,具有导电、导热、延展性,可被磁铁吸引。
(2)化学性质:较活泼的金属,+2、+3价两种价态
①与强氧化剂反应(如:Cl2 Br2 过量稀HNO3)生成+3价铁的化合物。如: 
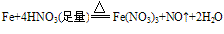
注:铁常温下在浓硫酸和浓硝酸中钝化,但加热可以反应,且被氧化成Fe3+
②与弱氧化剂反应(如S I2 H+ Cu2+)生成+2价铁的化合物,如: 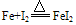
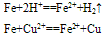
③铁与氧气、水蒸气反应生成Fe3O4(FeO·Fe2O3)

铁的性质:
- 物理性质:铁是黑色金属,具有铁磁性
- 铁的化学性质:
①与强氧化剂反应(如:Cl2、 Br2 、过量稀HNO3)生成+3价铁的化合物。如:
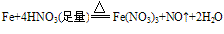
注:铁常温下在浓硫酸和浓硝酸中钝化,但加热可以反应,且被氧化成Fe3+
②与弱氧化剂反应(如S、 I2 、H+ 、Cu2+)生成+2价铁的化合物,如: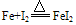
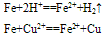
③铁与氧气、水蒸气反应生成Fe3O4(FeO·Fe2O3)

铁与稀硝酸的反应:
- 铁少量时:
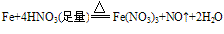
- 铁过量时:3Fe+8HNO3==3Fe(NO3)2+2NO+4H2O
两式可通过2Fe3++Fe==3Fe2+联系起来。
注意:
- 铁元素性质活泼,自然界中的铁元素几乎都是以化合态存在,只有在陨石中存在游离态的铁元素。
- 过量的铁与氯气反应,不会生成FeCl2,因为铁还原三价铁必须在水溶液中进行。
- 金属与强氧化性酸反应,不会生成H2。
化学性质:
铁元素性质活泼,有较强的还原性。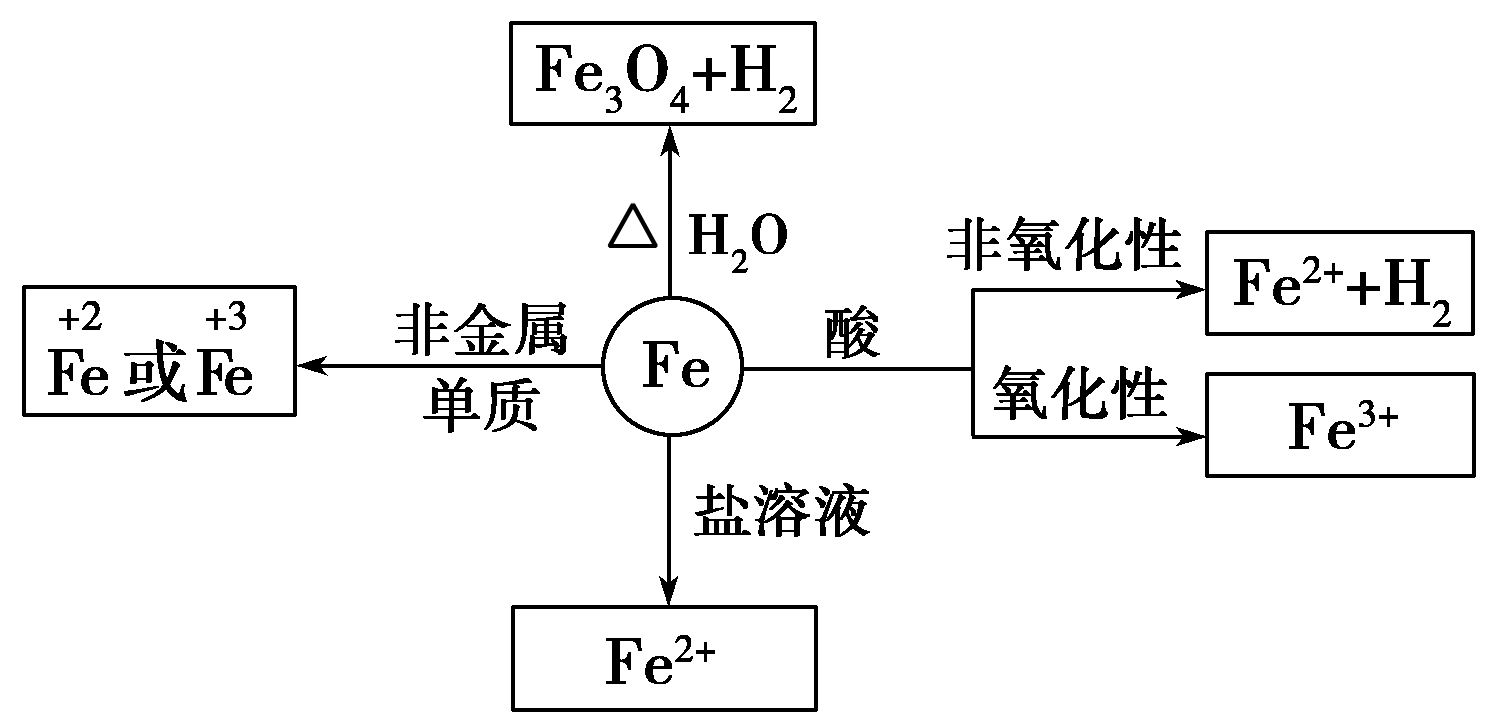
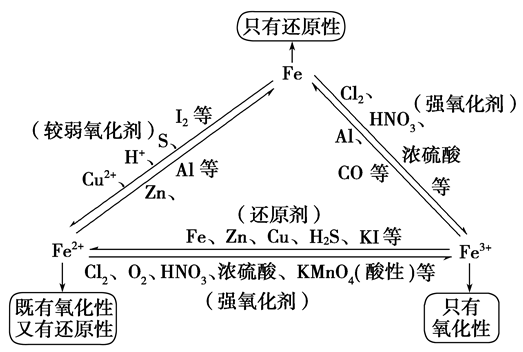
铁三角关系:

四氧化三铁:
又称磁性氧化铁,具有磁性的黑色晶体,不溶于水,具有优良的导电性。
四氧化三铁的性质:
(1)色态:具有磁性的黑色晶体
(2)别名:磁性氧化铁、氧化铁黑、磁铁、磁石、吸铁石、偏铁酸亚铁
(3)矿物:磁铁矿
(4)溶解性:不溶于水,与酸反应生成+2、+3铁盐
(5)稳定性:稳定
(6)还原性:在高温下,易氧化成三氧化二铁。4Fe3O4+O2 6Fe2O3
6Fe2O3
(7)氧化性:在高温下可与还原剂H2、CO、Al、C等反应。 


铁的氧化物:
| 化学式 | FeO | Fe2O3 | Fe3O4 |
| 俗称 | —— | 铁红 | 磁性氧化铁 |
| 色态 | 黑色粉末 | 红棕色粉末 | 黑色晶体 |
| 铁的价态 | +2 | +3 | +2、+3 |
| 水溶性 | 不溶 | 不溶 | 不溶 |
| 与酸反应 | FeO+2H+==Fe2++H2O | Fe2O3+6H+==2Fe3++3H2O | Fe3O4+8H+==Fe2++2Fe3++4H2O |
| 用途 | 玻璃色料 | 油漆、颜料 | 做颜料和抛光剂 |
| 氧化性 | 高温时都能与C、CO、H2反应,被还原生成Fe单质 | ||
Fe3+的性质:
含Fe3+的溶液都呈黄色,具有氧化性,
(1)与还原剂反应生成二价铁 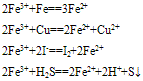
(2)与碱反应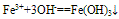
(3)Fe3+在水中易水解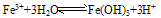
由于三价铁易水解,在保存铁盐盐溶液(FeCl3)时加入少量相应的酸(HCl),以防止Fe3+水解。
“铁三角”中的转化关系:
金属的腐蚀:
1.金属腐蚀的概念金属与周围的气体或液体物质发生氧化还原反应而引起损耗的现象。
2.金属腐蚀的实质金属原子(M)失去电子而被氧化的过程。
M-ne-==M n+
金属的电化学腐蚀:
不纯的金属或合金因发生原电池反应而造成的腐蚀。最普遍的钢铁腐蚀是:
负极:2Fe-4e-=2Fe2+
正极:O2+2H2O+4e-=4OH- (注:在少数情况下,若周围介质的酸性较强,正极的反应是:2H++2e-=H2↑)
金属的腐蚀以电化腐蚀为主.例如,钢铁生锈的主要过程为
(1)吸氧腐蚀:金属在酸性很弱或中性溶液里,空气里的氧气溶解于金属表面水膜中而发生的电化腐蚀。
①发生条件:水膜的酸性很弱或呈中性
②反应本质:形成原电池
③铁为负极,(氧化反应);正极反应:(还原反应)
(2)析氢腐蚀:在酸性较强的溶液中发生电化腐蚀时放出氢气,这种腐蚀叫做析氢腐蚀。
①发生条件:水膜的酸性较强
②反应本质:形成原电池
③铁为负极,(氧化反应);正极反应:(还原反应)
钢铁的电化学腐蚀的两种类型:


金属腐蚀快慢的判断:
金属腐蚀的快慢与下列两个因素有关:
(1)与构成原电池的材料有关,两极材料的活泼性差别越大,电动势越大,氧化还原反应的速率越快,活泼金属被腐蚀的速率就越快。
(2)与金属所接触的电解质溶液的性质有关,活泼金属在电解质溶液中的腐蚀快于在非电解质溶液中的腐蚀,在强电解质溶液中的腐蚀快于在弱电解质溶液中的腐蚀。一般来说,可用下列原则判断:电解原理引起的腐蚀>原电池原理引起的腐蚀> 化学腐蚀>有防护措施的腐蚀
与“铁单质及其化合物在生活、生产中应用广泛。请回答:(1)钢铁...”考查相似的试题有:
- 在CuO和Fe粉的混合物中,加入一定量的稀硫酸,并微热,当反应停止后,滤出不溶物,并向滤液中插入一枚铁钉,发现铁钉并无任何...
- 物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度有关。下列各组物质:①Cu与HNO3溶液 ②Cu与FeCl3...
- 红热的铁能与水蒸气反应,有氢气生成,现用如图所示装置进行铁在高温下与水蒸气反应的实验,并用简单的方法收集、检验生成的...
- 制备氯化物时,常用两种方法:①用金属与氯气直接化合制得;②用金属与盐酸反应制得,用以上两种方法都可制得的氯化物是[ ]A.A...
- (7分)请回答下列有关金属的问题。(1)铝是活泼金属,通常铝锅却很耐腐蚀,原因是 。(2)右边是某探究实验装置图。一段时间后,...
- (10分)已知:溴单质(Br2)、化合物与氯的性质相似,溴单质的水溶液呈黄色,溴单质的四氯化碳溶液呈橙红色。在足量的稀氯化亚铁...
- 向浓度为1mol/L的FeCl3溶液中通入足量的Cl2。下列有关溶液中离子浓度大小关系一定错误的是[ ]A.原FeCl2溶液中:c(Cl-)>c(Fe2...
- 氯化铁是常见的水处理剂,无水FeCl3的熔点为555K、沸点为588K。工业上制备无水FeCl3的一种工艺如下:无水FeCl3的一种工艺如下...
- 下列对钢铁制品采取的措施不能防止或减缓钢铁腐蚀的是( )A.保持表面干燥B.表面镀锌C.表面镶嵌铜块D.与电源负极相连
- 用石墨作电极电解1 L 1 mol·L-1CuSO4溶液,当c(Cu2+)="0.5" mol·L-1时,停止电解,向剩余溶液中加入下列何种物质可使电解质溶...