本试题 ““嫦娥一号”成功发射是我国迈出地球的第一步,月球作为地球的卫星被专家视为地球的“后院”和“第八大洲”,有着可以为人类利用的丰富资源.现有科学探索发现,月...” 主要考查您对物质组成元素的质量比
物质组成元素的质量分数
化合价的求法
元素的定义
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 物质组成元素的质量比
- 物质组成元素的质量分数
- 化合价的求法
- 元素的定义
定义:
化合物里各元素的质量比是原子个数与相对原子质量的乘积之比。即各元素原子的相对原子质量总和之比。计算的关键在于正确判断出各元素的原子总数。
公式:
各元素的质量比=各元素相对原子质量与相应原子个数的乘积之比。如化学式为AmBn的物质中,A、B两元素的质量比 =(A的相对原子质量×m):(B的相对原子质量×n)。
对概念公式的理解:
(1)元素是宏观概念,只讲种类,不讲个数。用元素符号表示时,7C素符号前后都不能写数字,如计算四氧化三铁(Fe3O4)中铁元素和氧元素的质量比时不能写成3Fe:4O
(2)在化学式中,原子个数比等于元素的质量除以其相对原子质量之比。如AmBn中A,B两元素的质量比为M:N,则化学式中A,B两元素的原子个数比m:n=
(3)当化学式中含有多种元素时,根据化学式可以计算出全部元素的质量比,也可以计算出其中某几种元素的质量比。
化学式中元素质量比的变式运算:
在AmBn中元素A,B的质量比等于各元素的相对原子质m与原子个数的乘积比,即A,B元素质量比= (A的相对原子质量×m):(B的相对原子质量×n),根据元素质量比的变形运算主要有:
(1)根据某化合物中元素的质最比求化学式根据化合物中元素的质量比(或元素的质量分数比)求化学式,其方法是通过元素的相对原子质量来推断化学式。通过组成元素质量比或元素的质量分数进行分式变换,转换成原子个数(比),推测化学式。
(2)根据某化合物中元素的质量比确定元素的化合价已知某化合物中元素的质量比确定某元素的化合价,可通过元素的质量比及元素的相对原子质量推断化学式中元素的原子个数之比,再根据化合物中正负化合价代数和为零的原则确定元素的化合价。
(3)根据元素的质量比确定元素的相对原子质量
化合物中元素的质量比等于相对原子质量与原子个数的乘积比,利用元素的质量比及化合物中各原子的个数即可求出元素的相对原子质量。相对原子质量之比等于元素的质量除以其原子个数所得的数值之比。
(4)物质的质量比与分子个数比之间的换算:
换算关系:物质的质量比 分子个数比、如SO3、SO2、O2三种物质的质量比为5:4:2,则SO3、SO2、O2的分子个数比为
分子个数比、如SO3、SO2、O2三种物质的质量比为5:4:2,则SO3、SO2、O2的分子个数比为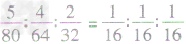 =1:1:1
=1:1:1
利用化学式变形求物质的质量比:
例:含有相同质量铁元素的Fe2O3和Fe3O4的质量比是多少?
解析:设含有相同质量铁元素的Fe2O3和Fe3O4的质量分别为x,y,为了使两者含铁元素的质量相等,可以将它们的化学式变形为铁原子数目相等的式子:
Fe2O3→Fe6O9 Fe3O4→Fe6O8
480 464
x y
x:y=480:464=30:29
答案:30:29
化合物里各元素的质量比是原子个数与相对原子质量的乘积之比。即各元素原子的相对原子质量总和之比。计算的关键在于正确判断出各元素的原子总数。
公式:
各元素的质量比=各元素相对原子质量与相应原子个数的乘积之比。如化学式为AmBn的物质中,A、B两元素的质量比 =(A的相对原子质量×m):(B的相对原子质量×n)。
对概念公式的理解:
(1)元素是宏观概念,只讲种类,不讲个数。用元素符号表示时,7C素符号前后都不能写数字,如计算四氧化三铁(Fe3O4)中铁元素和氧元素的质量比时不能写成3Fe:4O
(2)在化学式中,原子个数比等于元素的质量除以其相对原子质量之比。如AmBn中A,B两元素的质量比为M:N,则化学式中A,B两元素的原子个数比m:n=

(3)当化学式中含有多种元素时,根据化学式可以计算出全部元素的质量比,也可以计算出其中某几种元素的质量比。
化学式中元素质量比的变式运算:
在AmBn中元素A,B的质量比等于各元素的相对原子质m与原子个数的乘积比,即A,B元素质量比= (A的相对原子质量×m):(B的相对原子质量×n),根据元素质量比的变形运算主要有:
(1)根据某化合物中元素的质最比求化学式根据化合物中元素的质量比(或元素的质量分数比)求化学式,其方法是通过元素的相对原子质量来推断化学式。通过组成元素质量比或元素的质量分数进行分式变换,转换成原子个数(比),推测化学式。
(2)根据某化合物中元素的质量比确定元素的化合价已知某化合物中元素的质量比确定某元素的化合价,可通过元素的质量比及元素的相对原子质量推断化学式中元素的原子个数之比,再根据化合物中正负化合价代数和为零的原则确定元素的化合价。
(3)根据元素的质量比确定元素的相对原子质量
化合物中元素的质量比等于相对原子质量与原子个数的乘积比,利用元素的质量比及化合物中各原子的个数即可求出元素的相对原子质量。相对原子质量之比等于元素的质量除以其原子个数所得的数值之比。
(4)物质的质量比与分子个数比之间的换算:
换算关系:物质的质量比
 分子个数比、如SO3、SO2、O2三种物质的质量比为5:4:2,则SO3、SO2、O2的分子个数比为
分子个数比、如SO3、SO2、O2三种物质的质量比为5:4:2,则SO3、SO2、O2的分子个数比为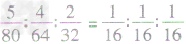 =1:1:1
=1:1:1利用化学式变形求物质的质量比:
例:含有相同质量铁元素的Fe2O3和Fe3O4的质量比是多少?
解析:设含有相同质量铁元素的Fe2O3和Fe3O4的质量分别为x,y,为了使两者含铁元素的质量相等,可以将它们的化学式变形为铁原子数目相等的式子:
Fe2O3→Fe6O9 Fe3O4→Fe6O8
480 464
x y
x:y=480:464=30:29
答案:30:29
定义:
物质中某元素的质量分数,就是该元素的质量与组成物质的各元素总质量之比。
公式:
某元素的质量分数=
如AmBn中A元素的质量分数=
若题目给出物质的化学式,又同时知道物质的实际质量,则可根据物质的质量×某元素的质量分数=该元素的质量,将其中所含元素的质量求出。同理,物质的质量=某元素质量÷该元素的质量分数。
公式的理解:
计算时应先列式计算,然后代入数据算出结果。如水中氢元素的质量分数=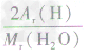 ×100%=
×100%= ×100%=
×100%= ×100%=11.1%而不能写成
×100%=11.1%而不能写成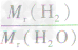 ×100%=
×100%= ×100%=
×100%= ×100%=11.1%
×100%=11.1%
化学式中质量分数的应用:
①已知物质的质量求所含的某元素的质量
利用公式:元素的质量=物质的质量×该元素的质量分数
②已知元素的质量求物质的质量
利用公式:物质的质量=元素的质量÷该元素的质量分数
③根据元素的质量分数确定物质的化学式
利用化学式的变形比较元素质量分数的大小:
例: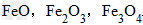 三种铁的氧化物按铁元素的质量分数由大到小排列的顺序为?
三种铁的氧化物按铁元素的质量分数由大到小排列的顺序为?
解析:三种含铁的氧化物的化学式可变形为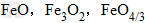 ,则三种含铁的氧化物中铁元素的质量分数分别为:
,则三种含铁的氧化物中铁元素的质量分数分别为: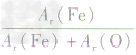 、
、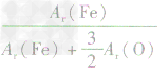 、
、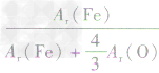 ,通过比较分母可知:
,通过比较分母可知: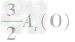 >
>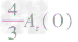 >Ar(O),故铁元素的质量分数由大到小排列的顺序为
>Ar(O),故铁元素的质量分数由大到小排列的顺序为 。
。
物质中某元素的质量分数,就是该元素的质量与组成物质的各元素总质量之比。
公式:
某元素的质量分数=

如AmBn中A元素的质量分数=

若题目给出物质的化学式,又同时知道物质的实际质量,则可根据物质的质量×某元素的质量分数=该元素的质量,将其中所含元素的质量求出。同理,物质的质量=某元素质量÷该元素的质量分数。
公式的理解:
计算时应先列式计算,然后代入数据算出结果。如水中氢元素的质量分数=
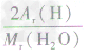 ×100%=
×100%= ×100%=
×100%= ×100%=11.1%而不能写成
×100%=11.1%而不能写成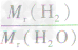 ×100%=
×100%= ×100%=
×100%= ×100%=11.1%
×100%=11.1%化学式中质量分数的应用:
①已知物质的质量求所含的某元素的质量
利用公式:元素的质量=物质的质量×该元素的质量分数
②已知元素的质量求物质的质量
利用公式:物质的质量=元素的质量÷该元素的质量分数
③根据元素的质量分数确定物质的化学式
利用化学式的变形比较元素质量分数的大小:
例:
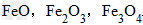 三种铁的氧化物按铁元素的质量分数由大到小排列的顺序为?
三种铁的氧化物按铁元素的质量分数由大到小排列的顺序为?解析:三种含铁的氧化物的化学式可变形为
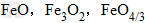 ,则三种含铁的氧化物中铁元素的质量分数分别为:
,则三种含铁的氧化物中铁元素的质量分数分别为: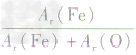 、
、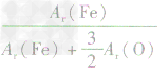 、
、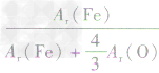 ,通过比较分母可知:
,通过比较分母可知: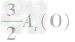 >
>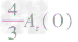 >Ar(O),故铁元素的质量分数由大到小排列的顺序为
>Ar(O),故铁元素的质量分数由大到小排列的顺序为 。
。求化合价:
化合价是元素的一种性质,它只有在元素彼此化合时才表现出来。在化合物中正、负化合价代数和等于零,这是求化合价的准则。
几种求法:
一、由化学式或根式
1.求AmBn化合物中A元素化合价的公式: (B元素的化合价×B的原子个数)/A的原子个数
2.求多元化合物中未知化合价的元素的化合价公式: (已知化合价诸元素价数的代数和)/未知化合价的元素的原子个数
3.根据正、负电荷数判断元素(或原子团)的化合价。 在根式中,正、负化合价总价数的代数和等于根式所带的正、负电荷数。
二、由元素质量比
1.(A元素的相对原子质量×B元素的化合价)/(B元素的相对原子质量×元素的化合价)=A元素的质量比值/B元素的质量比值
2.A元素的质量比值(或百分组成)×A的化合价/A的相对原子质量=B元素的质量比值(或百分比组成)×B的化合价/B相对原子质量
三、由质量比
(B的化合价×A的相对原子质量比值)/(A的化合价×B的相对原子质量比值)=A元素的质量比值/B元素的质量比值
正负代化合价数和为零:
【例1】试确定化合物K2MnO4中Mn元素的化合价。 解析:设化合物中Mn元素化合价为+x价,依化合物中各元素化合价正负代数和为零的原则有2×(+1)+1×(+x)+4×(-2)=0解之得x=6 故K2MnO4中Mn元素化合价为+6价。
电子层结构法
【例2】元素X的原子最外层上有1个电子,元素Y的原子最外层上有6个电子,则X、Y两元素可形成的化合物的化学式为[] A.XYB.X2YC.XY2D.X3Y 解析:本题的关键可以说是首先得确定在形成化合物时,X、Y两元素所表现的化合价。因X最外层上只有1个电子,最高正价为+1价,Y最外层6个电子,离8电子稳定结构尚差2个,故最低负价为-2价,则X、Y所形成化合物分子式为X2Y,应选B。
质量分数法
【例3】某元素的相对原子质量为59,在其氧化物中该元素的质量分数为71%,则它的化合价为[] A.+1B.+2C.+3D.+4 解析:设该元素的氧化物化学式为RxOy 依题意有59x/(59x+16y)*100%=71% 解得x/y=2:3 故化学式为R2O3,R化合价为+3价,选C。
质量守恒定律法
【例4】某金属氧化物与足量的盐酸反应,生成的氯化物与水的分子数之比为2∶3,则该金属的化合价是[] A.+1B.+2C.+3D.+4
解析:设生成的氯化物化学式为RClx,依题意有分子数之比RClx∶H2O=2∶3根据质量守恒定律可知,反应前后各元素的原子种类和数目不变,生成物中H、Cl的原子个数比也应为1:1,故x值为3,则R的化合价为+3价,选C。
相对分子质量法
【例5】某金属元素的氧化物相对分子质量为M,同价态的氯化物相对分子质量为N,则该元素的化合价数值为[]
解析:设该元素化合价为+x价,相对原子质量为MR
(1)如x为奇数时,氧化物化学式为R2Ox,氯化物化学式为RClx,据题意有
2MR+16x=M(1)
MR+35.5x=N(2)
(2)*2-(1)得x的值为x=+(2N-M)/55
(2)x为偶数时,氧化物化学式为Rox/2氯化物化学式为RClx,据题意有 MR+35.5x=N(4) x=+(N-M)/27.5
质量关系法
【例6】相对原子质量为M的金属单质ag与足量的稀硫酸反应,产生bg氢气,则反应中该金属元素的化合价为[]
解析:设金属在反应中化合价为+x价,则金属单质与生成H2有如下关系:
2R~xH2
2M 2x
a b
故应选B。
相关因素讨论法
【例7】某元素M原子最外层电子数少于5,其氧化物化学式为MxOy,氯化物化学式MClz当y∶z=1∶2时,M的化合价可能是[]
A.+1B.+2C.+3D.+4
解析:M的化合价在数值上等于z的值
如y=1z=2(合理) y=2z=4(合理) y=3z=6(与最外层电子数少于5不符) 故应选B、D。
化合价是元素的一种性质,它只有在元素彼此化合时才表现出来。在化合物中正、负化合价代数和等于零,这是求化合价的准则。
几种求法:
一、由化学式或根式
1.求AmBn化合物中A元素化合价的公式: (B元素的化合价×B的原子个数)/A的原子个数
2.求多元化合物中未知化合价的元素的化合价公式: (已知化合价诸元素价数的代数和)/未知化合价的元素的原子个数
3.根据正、负电荷数判断元素(或原子团)的化合价。 在根式中,正、负化合价总价数的代数和等于根式所带的正、负电荷数。
二、由元素质量比
1.(A元素的相对原子质量×B元素的化合价)/(B元素的相对原子质量×元素的化合价)=A元素的质量比值/B元素的质量比值
2.A元素的质量比值(或百分组成)×A的化合价/A的相对原子质量=B元素的质量比值(或百分比组成)×B的化合价/B相对原子质量
三、由质量比
(B的化合价×A的相对原子质量比值)/(A的化合价×B的相对原子质量比值)=A元素的质量比值/B元素的质量比值
正负代化合价数和为零:
【例1】试确定化合物K2MnO4中Mn元素的化合价。 解析:设化合物中Mn元素化合价为+x价,依化合物中各元素化合价正负代数和为零的原则有2×(+1)+1×(+x)+4×(-2)=0解之得x=6 故K2MnO4中Mn元素化合价为+6价。
电子层结构法
【例2】元素X的原子最外层上有1个电子,元素Y的原子最外层上有6个电子,则X、Y两元素可形成的化合物的化学式为[] A.XYB.X2YC.XY2D.X3Y 解析:本题的关键可以说是首先得确定在形成化合物时,X、Y两元素所表现的化合价。因X最外层上只有1个电子,最高正价为+1价,Y最外层6个电子,离8电子稳定结构尚差2个,故最低负价为-2价,则X、Y所形成化合物分子式为X2Y,应选B。
质量分数法
【例3】某元素的相对原子质量为59,在其氧化物中该元素的质量分数为71%,则它的化合价为[] A.+1B.+2C.+3D.+4 解析:设该元素的氧化物化学式为RxOy 依题意有59x/(59x+16y)*100%=71% 解得x/y=2:3 故化学式为R2O3,R化合价为+3价,选C。
质量守恒定律法
【例4】某金属氧化物与足量的盐酸反应,生成的氯化物与水的分子数之比为2∶3,则该金属的化合价是[] A.+1B.+2C.+3D.+4
解析:设生成的氯化物化学式为RClx,依题意有分子数之比RClx∶H2O=2∶3根据质量守恒定律可知,反应前后各元素的原子种类和数目不变,生成物中H、Cl的原子个数比也应为1:1,故x值为3,则R的化合价为+3价,选C。
相对分子质量法
【例5】某金属元素的氧化物相对分子质量为M,同价态的氯化物相对分子质量为N,则该元素的化合价数值为[]
解析:设该元素化合价为+x价,相对原子质量为MR
(1)如x为奇数时,氧化物化学式为R2Ox,氯化物化学式为RClx,据题意有
2MR+16x=M(1)
MR+35.5x=N(2)
(2)*2-(1)得x的值为x=+(2N-M)/55
(2)x为偶数时,氧化物化学式为Rox/2氯化物化学式为RClx,据题意有 MR+35.5x=N(4) x=+(N-M)/27.5
质量关系法
【例6】相对原子质量为M的金属单质ag与足量的稀硫酸反应,产生bg氢气,则反应中该金属元素的化合价为[]
解析:设金属在反应中化合价为+x价,则金属单质与生成H2有如下关系:
2R~xH2
2M 2x
a b
故应选B。
相关因素讨论法
【例7】某元素M原子最外层电子数少于5,其氧化物化学式为MxOy,氯化物化学式MClz当y∶z=1∶2时,M的化合价可能是[]
A.+1B.+2C.+3D.+4
解析:M的化合价在数值上等于z的值
如y=1z=2(合理) y=2z=4(合理) y=3z=6(与最外层电子数少于5不符) 故应选B、D。
概念:元素是具有相同核电荷数(即核内质子数)的一类原子的总称。
对元素概念的理解:
①元素是以核电荷数(即核内质子数)为标准对原子进行分类。只讲种类,不讲个数。
②质子数是划分元素种类的标准。质子数相同的原子和单核离子都属于同一种元素。如Na+与Na都属于钠元素,但Na+与NH4+不属于同一种元素。
③同种元素可以有不同的存在状态。如游离态和化合态。
④同种元素的离子因带电荷数不同,性质也不同。如Fe2+与Fe3+。
⑤同种元素的原子可以是不同种原子。如碳元素有三种不同中子数的碳原子:612C、613C、614C.
元素与原子的比较
元素、原子、分子与物质间的关系:
物质的组成可以从宏观和微观两个方面进行描述,其中元素是从宏观上对物质组成的描述,分子、原子是从微观上对物质构成的描述。其关系如下图;
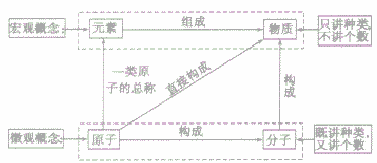
在讨论物质的组成和结构时,应注意规范地运用这些概念,现举例如下:
(1)由分子构成的物质,有三种说法(以二氧化碳为例):
①二氧化碳是由氧元素和碳元素组成的。
②二氧化碳是由二氧化碳分子构成的。
③每个二氧化碳分子是由2个氧原子和I个碳原子构成的。
(2)由原子(或离子)直接构成的物质(如汞、食盐),有两种说法:
①汞是由汞元素组成的;食盐是由钠元素和氯元素组成的。
②汞是由汞原子构成的;食盐是由钠离子和氯离子构成的。
同位素:
同位素指具有相同的质子数,但中子数不同的同一元素的不同原子,如氢有3种同位素,分别称为氕(H)、氘(D)、氚T),即原子核内质子数均为1,但中子数分别为0,1,2的氢原子。同位素有天然存在的,也有人工合成的。同一元素的同位素虽然中子数不同,但它们的化学性质基本相同。
对元素概念的理解:
①元素是以核电荷数(即核内质子数)为标准对原子进行分类。只讲种类,不讲个数。
②质子数是划分元素种类的标准。质子数相同的原子和单核离子都属于同一种元素。如Na+与Na都属于钠元素,但Na+与NH4+不属于同一种元素。
③同种元素可以有不同的存在状态。如游离态和化合态。
④同种元素的离子因带电荷数不同,性质也不同。如Fe2+与Fe3+。
⑤同种元素的原子可以是不同种原子。如碳元素有三种不同中子数的碳原子:612C、613C、614C.
元素与原子的比较
| 元素 | 原子 | |
| 概念 | 具有相同核电荷数〔即核内质子数)的一类原子的总称 | 化学变化中的最小粒子 |
| 区分 | 只讲种类,不讲个数 | 既讲种类,又讲个数 |
| 使用范围 | 用于描述物质的宏观组成 | 用于描述物质的微观构成 |
| 举例 | 水由氢元素和氧元素组成,或说水中含有氢元素和氧元素 | 每个水分子由两个氢原子和一个氧原子构成 |
| 联系 | 元素和原子是总体和个体的关系,原子是元素的个体,是构成并体现元素性质的最小微粒;元素是一类原子的总称一种元素可以包含几种原子 | |
元素、原子、分子与物质间的关系:
物质的组成可以从宏观和微观两个方面进行描述,其中元素是从宏观上对物质组成的描述,分子、原子是从微观上对物质构成的描述。其关系如下图;

在讨论物质的组成和结构时,应注意规范地运用这些概念,现举例如下:
(1)由分子构成的物质,有三种说法(以二氧化碳为例):
①二氧化碳是由氧元素和碳元素组成的。
②二氧化碳是由二氧化碳分子构成的。
③每个二氧化碳分子是由2个氧原子和I个碳原子构成的。
(2)由原子(或离子)直接构成的物质(如汞、食盐),有两种说法:
①汞是由汞元素组成的;食盐是由钠元素和氯元素组成的。
②汞是由汞原子构成的;食盐是由钠离子和氯离子构成的。
同位素:
同位素指具有相同的质子数,但中子数不同的同一元素的不同原子,如氢有3种同位素,分别称为氕(H)、氘(D)、氚T),即原子核内质子数均为1,但中子数分别为0,1,2的氢原子。同位素有天然存在的,也有人工合成的。同一元素的同位素虽然中子数不同,但它们的化学性质基本相同。
发现相似题
与““嫦娥一号”成功发射是我国迈出地球的第一步,月球作为地球的...”考查相似的试题有:
- 如图所示为一瓶医用注射液的标签,请仔细阅读后完成下列各题:(1)葡萄糖中碳、氢、氧的原子个数比为 ;(2)葡萄糖中碳元素...
- 由X、Y两种元素组成的化合物,两种元素的质量比为21 :8 ,原子量之比为 7 :2 ,则该化合物的化学式可能为[ ]A.XYB.X2Y3C.X3...
- 加碘盐一般指在食盐中加入碘酸钾(KIO3).如图是超市销售的某种精制碘盐标签的部分文字说明.计算:(1)碘酸钾中钾、碘、氧...
- (1)乳酸亚铁片可用于治疗缺铁性贫血.如图为乳酸亚铁说明书上部分文字.请仔细阅读后回答以下问题:①乳酸亚铁中含有______...
- 有一含有熟石灰的生石灰样品6g,与100g7.3%的稀盐酸恰好完全反应.则样品中钙的质量分数为( )A.64.7%B.65.7%C.66.7%D.6...
- 我国钢铁产量多年居世界第一位,每年要进口大量的铁矿石,赤铁矿(主要成分是氧化铁)是其中的一种.(1)氧化铁中铁元素的质...
- 下列说法中,正确的是( )A.黄铜是铜锌合金,其熔点比铜高,硬度比铜小B.rben第1核电站由于氢气泄漏引发爆炸,说明氢气具...
- (1)磷酸二氢钾(KH2PO4)大晶体已应用于我国研制的巨型激光器“神光二号”中,在磷酸二氢钾中磷元素的化合价是______价,磷酸...
- 甲醛(化学式为CH2O)是室内装璜时主要污染物之一,下列说法正确的是( )A.甲醛由一个碳元素、二个氢元素、一个氧元素组成B...
- 血红蛋白通过与氧结合形成氧合血红蛋白来输送氧气,人体需补铁促进血红蛋白的合成.这里的“铁”指的是( )A.原子B.分子C....