本试题 “合成氨原料可以由天然气制取。其主要反应为:CH4(g)+H2O(g)→CO(g)+3H2(g)(1)1m3(标准状况)CH4按上式完全反应,产生H2_______mol。(2)CH4和O2的反应为:...” 主要考查您对金属、非金属的有关计算
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 金属、非金属的有关计算
包括金属及化合物、金属与非金属化合物、非金属化合物之间的反应的计算,解此类题的关键是正确的写出反应方程式,明确物质间的等量关系。明确物质之间的反应,正确写出方程式,此类题可迎刃而解。
AlCl3与NaOH反应的相关计算:
1、求Al(OH)3沉淀的量
2、求反应物碱的量
铝与酸、碱反应的计算规律:
铝分别与盐酸、氢氧化钠溶液反应的原理: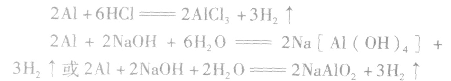
(1)等量铝分别与足量盐酸和氢氧化钠溶液反应,产生氢气的体积比为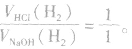
(2)足量的锅分别与等物质的量的盐酸和氢氧化钠溶液反应,产生氢气的体积比为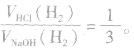
(3)一定量的铝分别和一定量的盐酸和氢氧化钠溶液反应,若产生氢气的体积比为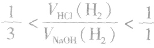 ,则必定是:
,则必定是:
①铝与盐酸反应时,铝过量而盐酸不足;
②铝与氢氧化钠溶液反应时,铝不足而氢氧化钠过量。
解有关硝酸与金属反应的计算题的技巧:
1.灵活运用得失电子守恒、原子守恒及溶液中的电荷守恒关系例如Cu与HNO3反应中就有以下等量关系:
(1)N原子守恒:反应前所有的N只存在于HNO3中;反应后含N的物质有HNO3的还原产物(假设此处有NO3、NO)和Cu(NO3)3,若HNO3过量,则过量HNO3中也含一部分N,则有:n(N)=n(NO2)+ n(NO)+2n[Cu(NO3)3]+n剩(HNO3)。
(2)得失电子守恒:在反应中失去电子的是参加反应的Cu, ;得到电子的是被还原的HNO3(假设还原产物为NO2、NO),NO3-+e→ NO2、NO3-+3e→NO。根据得失电子守恒,则有:
;得到电子的是被还原的HNO3(假设还原产物为NO2、NO),NO3-+e→ NO2、NO3-+3e→NO。根据得失电子守恒,则有: 
(3)溶液中的电荷守恒:在任何溶液中,阴离子所带负电荷总数与阳离子所带正电荷总数在数值上是相等的。在Cu与HNO3反应后的溶液中,若HNO3不过量,阳离子只有Cu2+,阴离子只有NO3-(此类计算不考虑H2O电离出的极少量的H+、OH-);若HNO3过量,溶液中阳离子有Cu2+和H+,阴离子只有NO3-。则有:
①若HNO3不过量: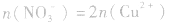
②若HNO3过量: 
2.铁与稀HNO3的反应规律 

(2)上述反应可以认为先发生反应①,若Fe有剩余则发生 ①×2+ ③即得反应②,所以,无论是反应①还是反应②,被还原的HNO3皆占参加反应的HNO3的
①×2+ ③即得反应②,所以,无论是反应①还是反应②,被还原的HNO3皆占参加反应的HNO3的 。
。
有关镁、铝的图像集锦:
Al(OH)3与Al3+、AlO2-之间的转化,是建立在 Al(OH)3两性基础上的,有关相互转化的配比和沉淀Al(OH)3的质量变化,见下表:
与“合成氨原料可以由天然气制取。其主要反应为:CH4(g)+H2O(g)→C...”考查相似的试题有:
- 将以等物质的量混合的Mg、Al混合物10g均分为4份,分别投入到足量的下列溶液中,产生氢气最多的是[ ]A.3 mol/L的盐酸B.18 mo...
- 向一定量的混合物中加入的稀硝酸恰好使混合物完全溶解,放出(标准状况)气体,往所得溶液中加入溶液,无血红色出现。若用足量...
- 将2.4 g镁和铝合金投入100 mL 2 mol/L的硫酸中,充分反应后,再向其中加入2 mol/L的NaOH溶液,当生成沉淀质量量大时,消耗NaO...
- 为测定一小块铁铝合金样品中的含铝量,现先将其溶于足量盐酸中,然后再向其中加入足量的烧碱溶液,待沉淀全部转化为红褐色时...
- 现有44g Mg、Al、Zn、Fe多种活泼金属粉末的混合物与体积为1L,质量分数为20%的硫酸溶液恰好完全反应,得到无水盐140g,则下列...
- 第IIA族元素R的单质及其相应氧化物的混合物12g,加足量水经完全反应后蒸干,得固体16g,试推测该元素可能为[ ]A.MgB.CaC.S...
- 将V mL NO和NO2的混合气体通过足量的水,充分反应后,得到一定体积的无色气体A。将此无色气体A与等体积的氧气混合,充分反应...
- 向10.6 g Na2CO3固体中加入足量盐酸,试计算:(1)参加反应的HCl的物质的量。(2)生成CO2的体积(标准状况)。
- 在25℃,101kPa条件下,将15 L O2通入10 L CO和H2的混合气中,使其完全燃烧,干燥后,恢复至原来的温度和压强。(1)若剩余气...
- 硫酸工厂排放的尾气中,含少量的二氧化硫。为防止其污染大气,在排放前必需进行尾气处理并设法进行综合利用。(1)硫酸工厂排放...