本试题 “下列有关叙述中,不正确的是[ ]A.将1 g AgI固体投入到100 mL饱和食盐水中,沉淀的质量会减小,颜色变浅B.在100 mL l mol/L的CaCl2溶液中,加入5mol/L NaOH...” 主要考查您对镁的单质及其化合物
沉淀溶解平衡
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 镁的单质及其化合物
- 沉淀溶解平衡
镁:
化学式Mg,它是一种银白色的轻质碱土金属,化学性质活泼,能与酸反应生成氢气,具有一定的延展性和热消散性。镁元素在自然界广泛分布,是人体的必需元素之一,原子结构示意图: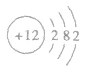 。
。
氧化镁:
化学式MgO是镁的氧化物,一种离子化合物。常温下为一种白色固体。氧化镁以方镁石形式存在于自然界中,是冶镁的原料。
氢氧化镁:
化学式Mg(OH)2,式量58.32。白色无定形粉末。难溶于水,易溶于稀酸和铵盐溶液。饱和水溶液的浓度为1.9毫克/升(18℃),呈碱性。加热到350℃失去水生成氧化镁。用做分析试剂,还用于制药工业。氧化镁跟水反应可得氢氧化镁。
镁及其化合物的物理性质和化学性质:
| 物理性质 | 化学性质 | |
| Mg | 银白色固体,密度1.738g﹒cm3-,熔点645℃,沸点1090℃,导电导热性较好,延展性较好 | ①镁和铝两元素的原子最外层分别有2个和3个电子。在参加化学反应时,容易失去最外层电子成为阳离子,表现还原性。 Mg-2e-==Mg2+ ②镁与非金属反应 O2+2Mg  2MgO 2MgOCl2+Mg  MgCl2 MgCl2 S+Mg  MgS MgS3Mg+N2  Mg3N2 Mg3N2 说明在常温下,镁能与空气里的氧气发生反应,生成一层致密的氧化物薄膜,从而使金属失去光泽。由于这层氧化物薄膜能阻止金属的继续氧化,所以镁有抗腐蚀性。 ③镁与酸反应 2HCl+Mg==MgCl2+H2↑ 2H++Mg==Mg2++H2↑ 镁跟硝酸、浓硫酸反应时,硝酸中的氮元素、硫酸中的硫元素被还原,不生成氢气。 ④镁跟某些氧化物反应 2Mg+CO2  C+2MgO C+2MgO ⑤镁跟水反应 Mg+2H2O  Mg(OH)2+H2↑ Mg(OH)2+H2↑ 说明:镁跟冷水反应非常缓慢. |
| MgO | 白色固体,离子化合物,熔点为3073K,硬度(莫氏)为6.5,难溶于水的固体,熔点很高,是很好的耐火材料 | 典型的碱性氧化物,不能与水反应 |
| Mg(OH)2 | 白色难溶于水的固体,其水溶液中c(OH-)很小,可以使酚酞溶液变成浅红色 Mg(OH)2(s)  Mg2+(aq)+2OH-(aq) Mg2+(aq)+2OH-(aq) |
①可与酸反应生成盐和水,如Mg(OH)2+2HCl==MgCl2+2H2O ②热稳定性差,受热容易分解 Mg(OH)2  MgO+H2O MgO+H2O |
工业制备镁:
电解熔融状态的氯化镁制取镁
阳极反应:2Cl--2e-==Cl2↑
阴极反应:Mg2++2e-==Mg
总反应:MgCl2(熔融) Mg+Cl2↑
Mg+Cl2↑
Mg2++2Cl-==Mg+Cl2↑
说明氧化镁比氯化镁熔点高,为了降低能耗,工业电解制取镁采用的原料是氯化镁而不是氧化镁。
氧化镁的应用:
氧化镁可用于染料,油漆,玻璃,化学试剂,医药,食品添加剂等方面,工业上利用MgO熔点高的特点,制造耐火材料。
1、定义:在一定条件下,当难容电解质的溶解速率与溶液中的有关离子重新生成沉淀的速率相等,此时溶液中存在的溶解和沉淀间的动态平衡,称为沉淀溶解平衡。
例如:
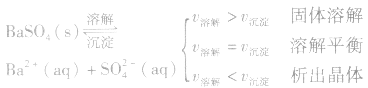
2、沉淀溶解平衡的特征:
(1)逆:沉淀溶解平衡是可逆过程。
(2)等:
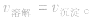
(3)动:动态平衡,溶解的速率和沉淀的速率相等且不为零。
(4)定:达到平衡时,溶液中各离子的浓度保持不变,
(5)变:当外界条件改变时,溶解平衡将发生移动,达到新的平衡。
3、沉淀溶解平衡的影响因素
(1)内因:难溶电解质本身的性质。
(2)外因
a.浓度:加水稀释,沉淀溶解平衡向溶解的方向移动,但
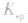 不变。
不变。 b.温度:多数难溶电解质溶于水是吸热的,所以升高温度,沉淀溶解平衡向溶解的方向移动,同时
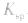 变大。
变大。 c.同离子效应:向沉淀溶解平衡体系中,加入含原体系中某离子的物质,平衡向沉淀生成的方向移动,但
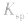 不变。
不变。 d.其他:向沉淀溶解平衡体系中,加入可与体系巾某些离子反应生成更难溶的物质或气体的物质,平衡向溶解的方向移动,
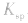 不变。
不变。沉淀溶解平衡的应用:
1.沉淀的生成
(1)意义:在涉及无机制备、提纯工艺的生产、科研、废水处理等领域中,常利用生成沉淀来达到分离或除去某些离子的目的。
(2)方法
a.调节pH法:如工业原料氯化铵中含杂质氯化铁,使其溶解于水,再加入氨水调节pH至7~8,可使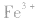 转变为
转变为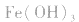 沉淀而除去。
沉淀而除去。 
b.加沉淀剂法:如以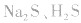 等作沉淀剂,使某些金属离子如
等作沉淀剂,使某些金属离子如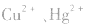 等生成极难溶的硫化物
等生成极难溶的硫化物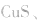
 等沉淀,也是分离、除杂常用的方法。
等沉淀,也是分离、除杂常用的方法。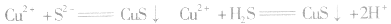
说明:化学上通常认为残留在溶液中的离子浓度小于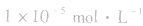 时即沉淀完全。
时即沉淀完全。
2.沉淀的溶解
(1)意义:在实际工作中,常常会遇到需要使难溶物质溶解的问题、根据平衡移动原理,对于在水中难溶的电解质,如果能设法不断地移去沉淀溶解平衡体系中的相应离子,使 平衡就会向沉淀溶解的方向移动,使沉淀溶解。
平衡就会向沉淀溶解的方向移动,使沉淀溶解。
(2)方法
a.生成弱电解质:加入适当的物质,使其与沉淀溶解平衡体系中的某离子反应生成弱电解质。如向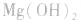 沉淀中加入
沉淀中加入 溶液,
溶液,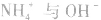 结合生成
结合生成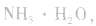 使
使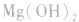 的溶解平衡向右移动。
的溶解平衡向右移动。
b.生成配合物:加入适当的物质,使其与沉淀反应生成配合物。
如:

c.氧化还原法:加入适当的物质,使其与沉淀发生氧化还原反应而使沉淀溶解。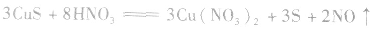
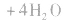
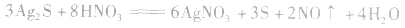
d.沉淀转化溶解法:本法是将难溶物转化为能用上述三种方法之一溶解的沉淀,然后再溶解:
如向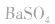 中加入饱和
中加入饱和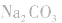 溶液使
溶液使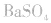 转化为
转化为 再将
再将 溶于盐酸。
溶于盐酸。
3.沉淀的转化
(1)实质:沉淀转化的实质就是沉淀溶解平衡的移动。一般来说,溶解度小的沉淀转化成溶解度更小的沉淀容易实现。 例如
(2)沉淀转化在工业上的应用在工业废水处理的过程中,用FeS等难溶物作沉淀剂除去废水中的重金属离子.
固体物质的溶解度:
绝对不溶解的物质是不存在的,任何难溶物质的溶解度都不为零。不同的固体物质在水中的溶解度差别很大,可将物质进行如下分类: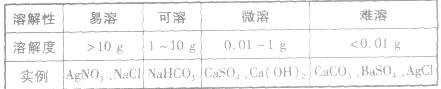
与“下列有关叙述中,不正确的是[ ]A.将1 g AgI固体投入到100 mL...”考查相似的试题有:
- FeCl3溶液中,加入难溶于水的CaCO3粉末,观察到CaCO3逐渐溶解,产生无色气体和红褐色沉淀。则:(1)气体为___,红褐色沉淀为__...
- 向饱和的BaSO4溶液中加水,下列叙述正确的是( )A.BaSO4溶解度增大,Ksp不变B.BaSO4溶解度、Ksp均增大C.BaSO4溶解度不变,K...
- 氯化银在水中存在溶解平衡:AgCl⇌Ag++Cl-.在相同温度下,将足量氯化银分别放入相同体积的下列溶液中,Ag+的浓度最小的是( ...
- 25℃时,几种弱酸溶液的pH如下表所示:弱酸CH3COOHH2SO3HCN物质的量浓度mol/L0.010.010.01pH3.42.35.6(1)25℃时,Na2SO3溶液...
- 将AgCl分别加入盛有:①5 mL水;② 6 mL 0.5 mol/L NaCl溶液;③10 mL 0.2 mol/L CaCl2溶液;④50 mL 0.1 mol/L 盐酸的烧杯中...
- 工业碳酸钠(纯度约为98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO42-等杂质,提纯工艺线路如下:Ⅰ、碳酸钠的饱和溶液在不同温度下...
- 重晶石(BaSO4)难溶于水,要转化成BaCO3再制备其他钡盐.工业上一般采用高温煅烧还原法;实验室可以采用沉淀转化法.●高温煅...
- 肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.(1)已知在25℃,101kPa时,16.0g N2H4在氧气中完全燃烧生成氮气...
- 高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂。⑴请完成与水反应的化学方程式:在处理水的过程中所起的作用是__...
- 常温下,在100mL 0.01mol•L-1KCl溶液中,加入1mL 0.01mol•L-1AgNO3溶液,下列说法正确的是(AgCl的Ksp=1.8×10-10mol2•L-2)(...