本试题 “25℃时,0.1mol•L-1的HA溶液中cH+cOH-=1010,0.01mol•L-1的BOH溶液pH=12.请回答下列问题:(1)HA是______(填“强电解质”或“弱电解质”,下同),BOH是______...” 主要考查您对溶液pH的有关计算
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 溶液pH的有关计算
溶液pH的计算方法:
总体原则
(1)若溶液为酸性,先求C(H+),再求pH;
(2)若溶液为碱性,先求C(OH-),再由 ,最后求pH。
,最后求pH。
1.单一溶液pH的计算
(1)强酸溶液,如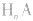 溶液,设溶质的物质的量浓度为
溶液,设溶质的物质的量浓度为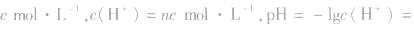
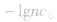
(2)强碱溶液,如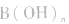 溶液,设溶质的物质的量浓度为
溶液,设溶质的物质的量浓度为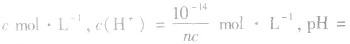
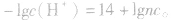
2.两强酸混合后pH的计算
由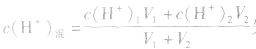 先求出混△后的
先求出混△后的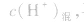 再根据公式
再根据公式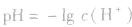 求pH。若两强酸溶液等体积混合,可采用速算方法:混合后溶液的pH等于混合前溶液pH小的加0.3。如pH=3和pH=5的盐酸等体积混合后,pH=3.3。
求pH。若两强酸溶液等体积混合,可采用速算方法:混合后溶液的pH等于混合前溶液pH小的加0.3。如pH=3和pH=5的盐酸等体积混合后,pH=3.3。
3.两强碱混合后pH的计算
由 先求出混台后的
先求出混台后的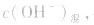 再通过
再通过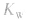 求出混合后的c(H+),最后求pH。若两强碱溶液等体积混合,可采用速算方法:混合后溶液的pH等于混合前溶液pH大的减0.3。如pH=9和pH=11的烧碱溶液等体积混合后, pH=10.7。
求出混合后的c(H+),最后求pH。若两强碱溶液等体积混合,可采用速算方法:混合后溶液的pH等于混合前溶液pH大的减0.3。如pH=9和pH=11的烧碱溶液等体积混合后, pH=10.7。
4.强酸与强碱混合后pH的计算
强酸与强碱混合的实质是中和反应即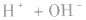
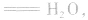 中和后溶液的pH有以下几种情况:
中和后溶液的pH有以下几种情况:
(1)若恰好中和,pH=7。
(2)若剩余酸,先求中和后的c(H+),再求pH。
(3)若剩余碱,先求中和后的c(OH-),再通过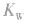 求出
求出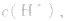 最后求pH.
最后求pH.
注意:强酸与强碱等体积混合后溶液酸碱性的判断规律:
①若二者pH之和为14,则混合后的溶液呈中性, pH=7
②若二者pH之和大于14,则混合后的溶液呈碱性
③若二者pH之和小于14,则混合后的溶液呈酸性,
5.溶液稀释后求pH
(1)对于强酸溶液,每稀释10倍体积,pH增大1 个单位;对于弱酸溶液,每稀释10倍体积,pH增大不足一个单位。无论稀释多少倍,酸溶液的pH不能等于或大于7,只能趋近于7。
(2)对于强碱溶液,每稀释10倍体积,pH减小1 个单位;对于弱碱溶液,每稀释10倍体积,pH减小不足一个单位。无论稀释多少倍,碱溶液的pH不能等于或小于7,只能趋近于7。
例如:pH=6的HCl溶液稀释100倍,溶液pH≈7 (不能大于7);
pH=8的NaOH溶液稀释100倍,溶液pH≈7(不能小于7):
pH=3的HCl溶液稀释100倍,溶液pH=5;
pH=10的NaOH溶液稀释100倍,溶液pH=8。
注意:弱酸、弱碱的稀释:在稀释过程中有浓度的变化,又有电离平衡的移动,不能求得具体数值,只能确定其pH范同。
例如:pH=3的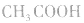 溶液稀释100倍,稀释后
溶液稀释100倍,稀释后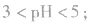
pH=10的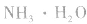 溶液稀释100倍,稀释后8<
溶液稀释100倍,稀释后8<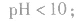
pH=3的酸溶液稀释100倍,稀释后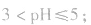
pH=10的碱溶液稀释100倍,稀释后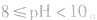
与“25℃时,0.1mol•L-1的HA溶液中cH+cOH-=1010,0.01mol•L-1的BOH...”考查相似的试题有:
- 现有三种常见治疗胃病药品的标签:药品中所含的物质均能中和胃里过量的盐酸,下列关于三种药片中和胃酸的能力比较,正确的是...
- 常温下柠檬水溶液的pH=3,其中c(OH-)是( )A.1×10-11mol•L-1B.1×10-3mol•L-1C.1×10-7mol•L-1D.O.1mol•L-1
- 下列说法合理的是( ) A.0.1mol/L的HCl溶液与0.2mol/L的CH3COONa溶液等体积混合,溶液pH<7 B.盐酸与氨水混合反应后,溶液...
- (1)三种弱酸HA、H2B、HC,电离常数的数值为1.8×10-5、5.6×10-11、4.9×10-10、4.3×10-7(数据顺序已打乱),已知三种酸和它...
- (1)常温下,0.1mol/LHA溶液与0.1mol/LNaOH溶液等体积混合后,溶液的pH______7;若溶液中c(Na+)=c(A-)+c(HA)时,pH___...
- 甲、乙两池电极材料都是铁棒与碳棒(如下图)。请回答下列问题:(1)若两池中均盛放CuSO4溶液,反应一段时间后:①有红色物质...
- 25℃时,将pH=3的HA溶液与pH=11的BOH溶液等体积混合,所得溶液pH小于7.下列说法不正确 的是( ) A.HA为弱酸 B.混合溶液中...
- 在25℃时,氨水与盐酸混合后,若混合液中c(NH4+)=c(Cl-),则溶液pH( )A.大于7B.小于7C.等于7D.无法判断
- 现有常温下的四种溶液(如下表),下列有关叙述中正确的是( )①②③④溶液氨水氢氧化钠溶液醋酸硫酸pH111133A.在①、②中分别加...
- 下列化合物:①HCl ②NaOH ③CH3COOH ④NH3•H2O ⑤CH3COONa ⑥NH4Cl(1)属于弱电解质的是______,溶液呈碱性的有______(填序号)...