本试题 “氯气是一种重要的化工原料,自来水的消毒、农药的生产、药物的合成等都需要用到氯气。(1)工业上通常采用电解法制氯气,其反应原理为:(用化学方程式表示)...” 主要考查您对氯气
氯气的制取
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 氯气
- 氯气的制取
氯气:
①化学式:Cl2
②氯元素在周期表中的位置:第三周期ⅦA族
③氯原子的电子式: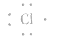
④氯的原子结构示意图: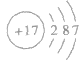
⑤氯原子的外围电子排布式:
⑥化学键类型:非极性共价键
⑦氯分子的电子式:
⑧氯分子的结构式:
氯气的物理性质和化学性质:
(1)物理性质:黄绿色,有刺激性气味,有毒,密度比空气大,能溶于水(1:2)。
(2)化学性质:氯气(Cl2)是双原子分子,原子的最外层有七个电子,是典型的非金属元素,单质是强氧化剂。
①氯气与金属反应: 2Na+Cl2
 2NaCl(反应剧烈,产生大量白烟) 2Fe+3Cl2
2NaCl(反应剧烈,产生大量白烟) 2Fe+3Cl2 2FeCl3(反应剧烈,产生大量棕褐色烟,溶于水成黄色溶液) Cu+Cl2
2FeCl3(反应剧烈,产生大量棕褐色烟,溶于水成黄色溶液) Cu+Cl2 CuCl2(反应剧烈,产生大量棕色的烟,溶于水成蓝色或绿色溶液)氯气能与绝大数金属都能发生反应,表明氯气是一种活泼的非金属单质。
CuCl2(反应剧烈,产生大量棕色的烟,溶于水成蓝色或绿色溶液)氯气能与绝大数金属都能发生反应,表明氯气是一种活泼的非金属单质。 ②与非金属的反应 H2+Cl2
 2HCl(纯净的氢气在氯气中安静的燃烧,芒白色火焰,在瓶口处有白雾产生)H2+Cl2
2HCl(纯净的氢气在氯气中安静的燃烧,芒白色火焰,在瓶口处有白雾产生)H2+Cl2 2HCl(发生爆炸) 2P+3Cl2
2HCl(发生爆炸) 2P+3Cl2 2PCl3(液态) PCl3+Cl2==PCl5(固态)磷在氯气中剧烈燃烧,产生大量的烟、雾。雾是PCl3,烟是PCl5。氯气能有很多非金属单质反应,如S、C、Si等。
2PCl3(液态) PCl3+Cl2==PCl5(固态)磷在氯气中剧烈燃烧,产生大量的烟、雾。雾是PCl3,烟是PCl5。氯气能有很多非金属单质反应,如S、C、Si等。 ③与碱反应 Cl2+2NaOH==NaCl+NaClO+H2O 2Cl2+2Ca(OH)2==CaCl2+Ca(ClO)2+2H2O
④与某些还原性物质反应:Cl2+2FeCl2===2FeCl3 Cl2+SO2+2H2O==2HCl+H2SO4
⑤有机反应(参与有机反应的取代和加成反应)
CH4+Cl2→CH3Cl+HCl
CH3Cl+Cl2→CH2Cl2+HCl
CH2Cl2+Cl2→CHCl3+HCl
CHCl3+Cl2→CCl4+HCl
Cl2+CH2=CH2→CH2Cl-CH2Cl(加成反应)
⑥与水反应 Cl2+H2O
 HCl+HClO
HCl+HClO 氯气的实验室制法:
(1)实验室用浓盐酸和二氧化锰反应制取氯气。 
(2)装置图: 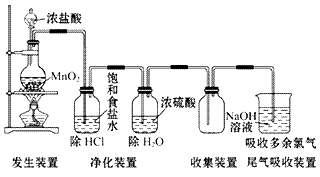
(3) 步骤: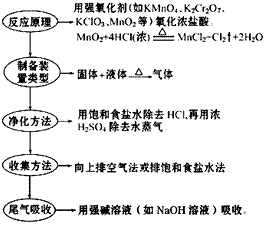

氯气的工业制法:
(1)电解饱和食盐水(氯碱工业),化学方程式为: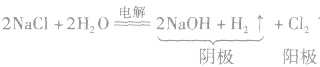
(2)电解熔融的氯化钠(可制得金属蚋),化学方程式为:
(3)电解熔融的氯化镁(可制得金属镁),化学方程式为:
发现相似题
与“氯气是一种重要的化工原料,自来水的消毒、农药的生产、药物...”考查相似的试题有:
- 下图所涉及的物质均为中学化学中的常见物质,其中C为气体单质一种主要成分、D在常温下是黄绿色气体、E为Fe单质,其余为化合物...
- 在足量的稀氯化亚铁溶液中,加入1~2滴液溴,振荡后,溶液变为黄色。(1)甲同学认为这不是发生化学反应所致,使溶液变黄色的物...
- 有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如下图所示。E的单质...
- 下列化合物中,既能通过单质间化合直接制取,也能通过单质和盐酸反应直接制取的是A.CuCl2B.FeCl2C.FeCl3 D.MgCl2
- 如图中,A是氯气的发生装置,B、C是净化气体的装置,D中装铁丝网;反应后E的底部有棕色固体聚集;F是吸收多余气体的装置。(1...
- 新制氯水呈______色,是溶液中有______存在;向氯水中加入锌粒,立即有______生成,说明氯水呈______性;将硝酸银溶液滴加入...
- 利用下列各组中的物质制备并收集相应的气体,能采用如图所示装置的是A.浓氨水和固体NaOH制NH3B.过氧化氢溶液和二氧化锰制O2...
- 某学生设计如下实验装置利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题:(1)A仪器的名...
- 二氧化锰(MnO2)与浓盐酸混合加热可得到氯气,下图是制取并探究Cl2化学性质的装置图。(1)圆底烧瓶中发生反应的化学方程式...
- (每空2分,共12分)实验室欲配制220mL 0.2 mol·L-1的碳酸钠溶液,回答下列问题:可供选择的仪器:①量筒②胶头滴管③托盘天平④...