本试题 “背景材料:①2004年夏季,特氟隆不粘锅事件引起公众关注;②2004年冬季,诺贝尔化学奖授予研究蛋白质的科学家;③2005年初春,广东大部分地区进行了人工降雨;④2...” 主要考查您对氯气
蛋白质
聚合物的单体
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 氯气
- 蛋白质
- 聚合物的单体
氯气:
①化学式:Cl2
②氯元素在周期表中的位置:第三周期ⅦA族
③氯原子的电子式: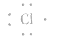
④氯的原子结构示意图: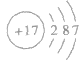
⑤氯原子的外围电子排布式:
⑥化学键类型:非极性共价键
⑦氯分子的电子式:
⑧氯分子的结构式:
氯气的物理性质和化学性质:
(1)物理性质:黄绿色,有刺激性气味,有毒,密度比空气大,能溶于水(1:2)。
(2)化学性质:氯气(Cl2)是双原子分子,原子的最外层有七个电子,是典型的非金属元素,单质是强氧化剂。
①氯气与金属反应: 2Na+Cl2
 2NaCl(反应剧烈,产生大量白烟) 2Fe+3Cl2
2NaCl(反应剧烈,产生大量白烟) 2Fe+3Cl2 2FeCl3(反应剧烈,产生大量棕褐色烟,溶于水成黄色溶液) Cu+Cl2
2FeCl3(反应剧烈,产生大量棕褐色烟,溶于水成黄色溶液) Cu+Cl2 CuCl2(反应剧烈,产生大量棕色的烟,溶于水成蓝色或绿色溶液)氯气能与绝大数金属都能发生反应,表明氯气是一种活泼的非金属单质。
CuCl2(反应剧烈,产生大量棕色的烟,溶于水成蓝色或绿色溶液)氯气能与绝大数金属都能发生反应,表明氯气是一种活泼的非金属单质。 ②与非金属的反应 H2+Cl2
 2HCl(纯净的氢气在氯气中安静的燃烧,芒白色火焰,在瓶口处有白雾产生)H2+Cl2
2HCl(纯净的氢气在氯气中安静的燃烧,芒白色火焰,在瓶口处有白雾产生)H2+Cl2 2HCl(发生爆炸) 2P+3Cl2
2HCl(发生爆炸) 2P+3Cl2 2PCl3(液态) PCl3+Cl2==PCl5(固态)磷在氯气中剧烈燃烧,产生大量的烟、雾。雾是PCl3,烟是PCl5。氯气能有很多非金属单质反应,如S、C、Si等。
2PCl3(液态) PCl3+Cl2==PCl5(固态)磷在氯气中剧烈燃烧,产生大量的烟、雾。雾是PCl3,烟是PCl5。氯气能有很多非金属单质反应,如S、C、Si等。 ③与碱反应 Cl2+2NaOH==NaCl+NaClO+H2O 2Cl2+2Ca(OH)2==CaCl2+Ca(ClO)2+2H2O
④与某些还原性物质反应:Cl2+2FeCl2===2FeCl3 Cl2+SO2+2H2O==2HCl+H2SO4
⑤有机反应(参与有机反应的取代和加成反应)
CH4+Cl2→CH3Cl+HCl
CH3Cl+Cl2→CH2Cl2+HCl
CH2Cl2+Cl2→CHCl3+HCl
CHCl3+Cl2→CCl4+HCl
Cl2+CH2=CH2→CH2Cl-CH2Cl(加成反应)
⑥与水反应 Cl2+H2O
 HCl+HClO
HCl+HClO 蛋白质:
相对分子质量在10000以上的,并具有一定空间结构的多肽,称为蛋白质。
组成:蛋白质是南C、H、O、N、S等元素组成的结构复杂的化合物。
蛋白质的性质:
(1)两性
由于形成蛋白质的多肽是由多个氨基酸分子脱水形成的,在多肽链的两端必有一NH2和一COOH,因此蛋白质既能与酸反应,又能与碱反应,表现为两性。
(2)水解
反应蛋白质在酸、碱或酶的作用下,水解生成相对分子质量较小的肽类化合物,最终逐步水解得到各种氨基酸。
(3)盐析
向蛋白质溶液巾加入某些无机盐(如硫酸铵、硫酸钠和氯化钠等)达到一定浓度时,会使蛋白质的溶解度降低而从溶液中析出,这种作用称为盐析。
注意:盐析只改变蛋白质的溶解度,没有改变它的化学性质,析出的蛋白质还能溶于水,故盐析是可逆的过程。
(4)变性
在某些物理因素(如加热、加压、搅拌、紫外线照射和超声波等)或化学因素(如强酸、强碱、重金属盐、三氯乙酸、甲醛、乙醇和丙酮等)的影响下,蛋白质的理化性质和生理功能发生改变的现象,称为蛋白质的变性。
注意:蛋白质的变性是一个不可逆过程,变性后的蛋白质在水中不能重新溶解,同时也会失去原有的生理活性。
(5)蛋白质的颜色反应
蛋白质可以与许多试剂发生颜色反应,如硝酸可以使含有苯环结构的蛋白质变黄,这是含苯环的蛋白质的特征反应,常用来鉴别部分蛋白质。在使用浓硝酸时,不慎将浓硝酸溅在皮肤上而使皮肤发黄,就是蛋白质发生颜色反应的结果。
(6)蛋白质的灼烧
蛋白质在灼烧时产生烧焦羽毛的气味,可以据此鉴别真丝和人造丝。
能够发生水解反应的物质归纳:
1.盐类水解
(1)强酸弱碱盐水解呈酸性,如CuSO4、NH4NO3、 FeCl3、Al2(SO4)3等。
(2)强碱弱酸盐水解呈碱性,如KF、Na2CO3、 K2SiO3、NaAlO2等。
2.氮化镁的水解 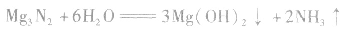
3.碳化钙的水解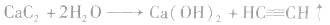
4.卤代烃的水解卤代烃水解生成醇,如 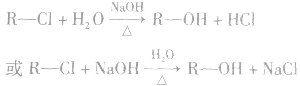
5.酯的水解 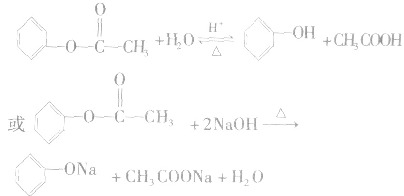
6.糖类水解糖类水解的最终产物是单糖,如 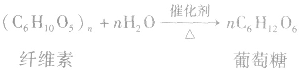
7.蛋白质的水解蛋白质水解的最终产物足多种氨基酸,肽键的断裂如下图所示: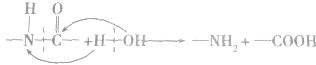
聚合物的单体:
用于聚合的小分子则被称为“单体”。如: 单体为CH2=CH2
单体为CH2=CH2
用于聚合的小分子则被称为“单体”。如:
 单体为CH2=CH2
单体为CH2=CH2 发现相似题
与“背景材料:①2004年夏季,特氟隆不粘锅事件引起公众关注;②200...”考查相似的试题有:
- 下列说法不正确的是( )①在NaOH的酚酞稀溶液中不断通入氯气,溶液颜色呈现出红→无→浅黄绿的变化;②氯水具有漂白性,在紫色的...
- 下列说法不正确的是( )A.新制的饱和氯水呈浅黄绿色,久置后颜色逐渐变浅至无色B.氯水有漂白性是因为HClO的强氧化性C.漂...
- 下图所涉及的物质均为中学化学中的常见物质,其中C为气体单质一种主要成分、D在常温下是黄绿色气体、E为Fe单质,其余为化合物...
- 四支试管分别充满O2、NO2、Cl2、NH3四种气体,把它们分别倒立于盛有下列各种液体的水槽中,发生的现象如下图所示,其中充满Cl...
- 下列关于物质的性质与用途的说法中不正确的是( )A.氧化铝的熔点很高,因此可用做耐火材料B.某些金属氧化物灼烧时有特殊的...
- 氯水具有多种性质,根据新制氯水分别与如图五种物质发生的反应填空(氯水足量):(1)a、b、c中反应的离子方程式为: 。e中的...
- 下列说法正确的是( )A.某溶液滴入AgNO3溶液,产生白色沉淀,则该溶液中一定含有氯离子B.某溶液与KI淀粉溶液混合后,出现...
- 亚硫酰氯(SOCl2)是重要的有机物卤化剂和电池的介质,生产上和生活中有着广泛应用,亚硫酰氯易水解,在140℃以上可发生:4SOCl2...
- 下列说法中正确的是[ ]A.石油裂解可以得到氯乙烯B.油脂水解可得到氨基酸和甘油C.所有烷烃和蛋白质中都存在碳碳单键D.淀粉...
- (1)做装饰板的贴画,常用氨基树脂,它的结构片段是它可以看作是两种单体的缩水产物,这两种单体的结构简式是___________,___...