本试题 “下列实验操作中,正确的是( )①.把pH试纸浸入待测溶液中,测定溶液的pH②.用渗析法除去Fe(OH)3胶体中的Cl-离子③.苯酚沾在皮肤上,应立即用酒精清洗④.称...” 主要考查您对实验中的事故处理
化学实验安全
渗析
物质的分离
pH值的测定
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 实验中的事故处理
- 化学实验安全
- 渗析
- 物质的分离
- pH值的测定
实验过程中常见意外事故的处理方法:
(1)割伤:取出伤口中的玻璃或固体物,用蒸馏水洗后涂上红药水,用绷带扎住或敷上创可贴药膏。大伤口则应先按紧主血管以防止大量出血,急送医院治疗。
(2)烫伤:轻轻涂以玉树油或鞣酸油膏,重伤涂以烫伤油膏后送医院。
(3)试剂灼伤
①酸:立即用大量水洗,再以3%-5%的碳酸氢钠溶液洗,最后用水洗。严重时要消毒,拭干后涂烫伤油膏。
②碱:立即用大量水洗,再以1%-5%硼酸液洗,最后用水洗。严重时同上处理。
③溴:立即用大量水洗,再以酒精檫至无溴液存在为止,然后涂上甘油或烫伤油膏。
④钠:可见的小块用镊子移去,其余与碱灼伤处理相同。
(4)试剂或异物溅入眼内:任何情况下都要先洗涤,急救后送医院。
①酸:用大量水洗,再以1%的碳酸氢钠溶液洗。
②碱:用大量水洗,再以1%硼酸液洗。
③溴:用大量水洗,再以1%的碳酸氢钠溶液洗。
④玻璃:用镊子移去碎玻璃,或在盆中用水洗,切勿用手揉动。
(5)中毒:溅入口中尚未咽下者应立即吐出,再用大量的水清洗口腔,如已吞下者,应根据毒物的性质给以解毒剂,可内服一杯含有5~10cm3稀硫酸铜溶液的温水,再用手指伸入咽喉部促使呕吐,并立即送医院。
(6)不渗触电时,立即切断电源,必要时进行人工呼吸,找医生抢救。
(7)起火:要立即切断电源,并采取适当的措施防止火势扩展。
(1)割伤:取出伤口中的玻璃或固体物,用蒸馏水洗后涂上红药水,用绷带扎住或敷上创可贴药膏。大伤口则应先按紧主血管以防止大量出血,急送医院治疗。
(2)烫伤:轻轻涂以玉树油或鞣酸油膏,重伤涂以烫伤油膏后送医院。
(3)试剂灼伤
①酸:立即用大量水洗,再以3%-5%的碳酸氢钠溶液洗,最后用水洗。严重时要消毒,拭干后涂烫伤油膏。
②碱:立即用大量水洗,再以1%-5%硼酸液洗,最后用水洗。严重时同上处理。
③溴:立即用大量水洗,再以酒精檫至无溴液存在为止,然后涂上甘油或烫伤油膏。
④钠:可见的小块用镊子移去,其余与碱灼伤处理相同。
(4)试剂或异物溅入眼内:任何情况下都要先洗涤,急救后送医院。
①酸:用大量水洗,再以1%的碳酸氢钠溶液洗。
②碱:用大量水洗,再以1%硼酸液洗。
③溴:用大量水洗,再以1%的碳酸氢钠溶液洗。
④玻璃:用镊子移去碎玻璃,或在盆中用水洗,切勿用手揉动。
(5)中毒:溅入口中尚未咽下者应立即吐出,再用大量的水清洗口腔,如已吞下者,应根据毒物的性质给以解毒剂,可内服一杯含有5~10cm3稀硫酸铜溶液的温水,再用手指伸入咽喉部促使呕吐,并立即送医院。
(6)不渗触电时,立即切断电源,必要时进行人工呼吸,找医生抢救。
(7)起火:要立即切断电源,并采取适当的措施防止火势扩展。
预防事故发生的措施:
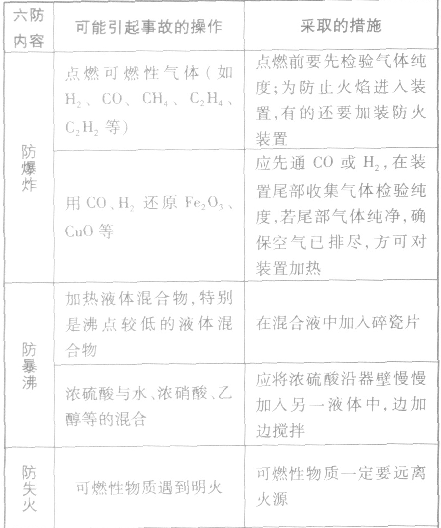
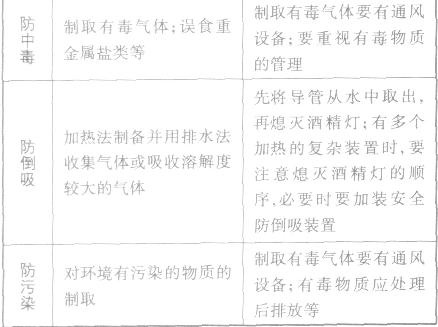
化学实验安全原则:
(1)遵守实验室规则。
(2)了解安全措施。
(3)掌握正确的操作方法。
(4)重视并逐渐熟悉污染物和废弃物的处理方法。
化学实验安全总结:
(1)给试管里的固体加热,应先将试管干燥或使试管均匀受热,这样可以防止加热过程中试管炸裂。
(2)给试管里的液体加热时,试管不能直立。应与桌面成45°角,并且试管内的液体不要超过试管容积的1/3,更不能将试管对着有人的方向,这样可以防止加热过程中液体沸腾冲出烫伤人。
(3)使用酒精灯的过程中,不能向燃着的灯内添加酒精,也不能用酒精灯引燃另一只酒精灯,这样做可避免失火。
(4)用酒精灯加热烧杯中的液体时,应垫上石棉网,可防止烧坏受热不均炸裂。
(5)蒸发溶液时,应用玻璃棒不断搅拌,这样做可避免液体受热不均溅出伤人。
(6)点燃可燃性气体如H2、CH4、CO前一定要检验它们的纯度,这样做可防止不纯气体点燃发生爆炸。
(7)做CO还原CuO实验时,在加热之前应先通入CO,这样做可赶跑空气,防止装置内CO与空气混合受热时爆炸,同时还要进行尾气处理,防止CO污染空气。
(8)用KMnO4和KClO3制O2时,要注意药品中不要混有可燃物,否则有引起试管爆炸的危险。
(9)用KMnO4制O2时,不要忘记在试管口塞一团棉花,否则加热时KMnO4粉末会溅入导管内堵塞导管,从而使试管炸裂。
(10)加热某些固体药品制取氧气,并用排水法收集结束时,应先将导管移出水槽,然后再熄灭酒精灯,这样做可防止水槽中的水倒流到试管,使热的试管炸裂。
(11)白磷等易燃物应保存在水中,用后不能随意丢弃,因为白磷着火点较低,易发生缓慢氧化而自燃。这样做可避免发生火灾。
(12)做探究燃烧条件的实验时,白磷的燃烧应在通风橱内进行。
(13)稀释浓硫酸时,一定要将浓硫酸慢慢注入水中,并用玻璃棒不断搅拌,切不可将水倒入浓硫酸中。这样可防止水浮在酸液上方,沸腾后溅出造成事故。
(14)蒸馏时,可在烧瓶中加入几粒沸石或碎瓷片,这样可防止液体暴沸。
(1)遵守实验室规则。
(2)了解安全措施。
(3)掌握正确的操作方法。
(4)重视并逐渐熟悉污染物和废弃物的处理方法。
化学实验安全总结:
(1)给试管里的固体加热,应先将试管干燥或使试管均匀受热,这样可以防止加热过程中试管炸裂。
(2)给试管里的液体加热时,试管不能直立。应与桌面成45°角,并且试管内的液体不要超过试管容积的1/3,更不能将试管对着有人的方向,这样可以防止加热过程中液体沸腾冲出烫伤人。
(3)使用酒精灯的过程中,不能向燃着的灯内添加酒精,也不能用酒精灯引燃另一只酒精灯,这样做可避免失火。
(4)用酒精灯加热烧杯中的液体时,应垫上石棉网,可防止烧坏受热不均炸裂。
(5)蒸发溶液时,应用玻璃棒不断搅拌,这样做可避免液体受热不均溅出伤人。
(6)点燃可燃性气体如H2、CH4、CO前一定要检验它们的纯度,这样做可防止不纯气体点燃发生爆炸。
(7)做CO还原CuO实验时,在加热之前应先通入CO,这样做可赶跑空气,防止装置内CO与空气混合受热时爆炸,同时还要进行尾气处理,防止CO污染空气。
(8)用KMnO4和KClO3制O2时,要注意药品中不要混有可燃物,否则有引起试管爆炸的危险。
(9)用KMnO4制O2时,不要忘记在试管口塞一团棉花,否则加热时KMnO4粉末会溅入导管内堵塞导管,从而使试管炸裂。
(10)加热某些固体药品制取氧气,并用排水法收集结束时,应先将导管移出水槽,然后再熄灭酒精灯,这样做可防止水槽中的水倒流到试管,使热的试管炸裂。
(11)白磷等易燃物应保存在水中,用后不能随意丢弃,因为白磷着火点较低,易发生缓慢氧化而自燃。这样做可避免发生火灾。
(12)做探究燃烧条件的实验时,白磷的燃烧应在通风橱内进行。
(13)稀释浓硫酸时,一定要将浓硫酸慢慢注入水中,并用玻璃棒不断搅拌,切不可将水倒入浓硫酸中。这样可防止水浮在酸液上方,沸腾后溅出造成事故。
(14)蒸馏时,可在烧瓶中加入几粒沸石或碎瓷片,这样可防止液体暴沸。
渗析:
| 名称 | 用途 | 装置 | 举例 | 注意事项 |
| 渗析 | 胶体提纯、精制 | 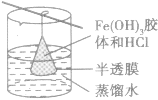 |
除去Fe(OH)3胶体中的HCl | 要不断更换烧杯中的水或改用流动水,以提高渗析效果 |
分离与提纯的原则和要求:
(1)选择分离与提纯方法应遵循的原则
①不增:指不能引入新的杂质。
②不减:指应尽可能减少被分离与提纯的物质的损失。
③易分离:指如果使用试剂除去杂质时,要求反应后的产物跟被提纯的物质容易分离。
④易复原:指分离物或被提纯的物质都要容易复原。
(2)分离与提纯操作过程应遵循“三必须”
①除杂质试剂必须过量;
②过量试剂必须除尽(因过量试剂会带人新的杂质);
③除杂途径必须选最佳。
常见的分离与提纯的方法:
(1)物质分离与提纯常用的物理方法
| 方法 | 适用范围或原理 | 装置 | 举例 | 注意事项 |
| 过滤 | 分离固体和液体混合物 | 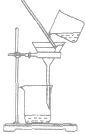 |
粗盐提纯时把粗盐溶于水,经过滤把不溶于水的杂质除去 | ①要“一贴二低三靠” 滤纸紧贴漏斗内壁;滤纸边缘低于漏斗口,漏斗里液面低于滤纸边缘;烧杯口紧靠玻璃棒,玻璃捧下端紧靠三层滤纸.漏斗下端紧靠烧杯内壁。 ②必要时洗涤沉淀物(在过滤器中加少量水),不可搅拌 |
| 结晶 重结晶 |
分离各组分在溶剂中的溶解度随温度变化不同的混合物 | 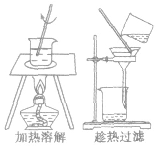 |
KNO3溶解度随温度变化大, NaCl溶解度随温度变化小,可用该法从二者的混合液中提纯KNO3 | ①一般先配较高温度下的浓溶液,然后降温结晶 ②结晶后过滤,分离出晶体 |
| 蒸发 | 溶解度随温度变化较小的物质 |  |
从食盐水溶液中提取食盐晶体 | ①溶质应不易分解、不易水解、不易被氧气氧化 ②蒸发过程应不断搅拌 ③近干时停止加热,余热蒸干 |
| 蒸馏 | 分离沸点不同的液体混合物 | 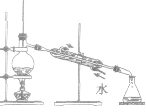 |
制无水乙醇(加生石灰)、硝酸的浓缩[加浓硫酸或 Mg(NO3)2] | ①温度计水银球在蒸馏烧瓶支管口处 ②加沸石(碎瓷片) ③注意冷凝管水流方向应下进上出 ④不可蒸干 |
| 分馏 | 分离多种液态混合物 | 同蒸馏 | 石油分馏 | 同蒸馏 |
| 萃取 | 分离两种互溶的液体 |  |
CCl4把溴水中的Br2萃取出来 |
①萃取后再进行分液操作 ②对萃取剂的要求:与原溶剂互不混溶,不反应;溶质在其中的溶解度比在原溶剂中大;溶质不与萃取剂反应 ③萃取后得到的仍是溶液,一般要通过分馏等方法进一步分离 |
| 分液 | 分离两种不相混溶的液体(密度不同) | 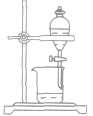 |
水、苯的分离 | 下层液体从下口放出,上层液体从上口倒出 |
| 液化 | 利用气体混合物中某组分易液化的特点来分离 | 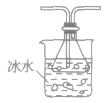 |
除去SO2中的SO3 | 可把锥形瓶换成硬质大试管 |
| 盐析 | 利用某些物质在加某些无机盐时,其溶解度降低而凝聚的性质来分离物质 | —— | 从皂化液中分离肥皂、甘油,蛋白质的盐析 | 盐析是物理变化。盐析之后一般要采取过滤的操作 |
| 洗气 | 杂质气体易溶于某液体 | 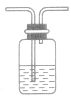 |
除去CO2中的HCl气体,可使混合气体通过盛有饱和NaHCO3 溶液的洗气瓶 | ①从洗气瓶的长导管一端进气 ②混合物中气体溶解度差别较大 |
| 升华 | 利用某些物质有升华的特性 |  |
粗碘中碘与钾、钠、钙、镁的碘化物混合,利用碘易升华的特点将碘与杂质分开 | 升华物质的集取方法不作要求 |
| 渗析 | 胶体提纯、精制 |  |
除去Fe(OH)3胶体中的HCl | 要不断更换烧杯中的水或改用流动水,以提高渗析效果 |
(2)物质分离与提纯常用的化学方法:
①加热法
混合物中混有某些热稳定性差的物质时,可直接加热,使热稳定性差的物质分解而分离出来。例如:食盐中混有氯化铵、纯碱中混有小苏打等均可直接加热除去杂质。
②沉淀法
在混合物中加入某试剂,使其中一种以沉淀形式分离出去的方法。使用该方法一定要注意不能引入新杂质,若使用多种试剂将溶液中不同粒子逐步沉淀时,应注意后加入试剂能将先加入的过量试剂除去,最后加入的试剂不引入新杂质。例如:加入适量BaCl2溶液可除去NaCl中混有的Na2SO4。
③转化法
利用化学反应将某种物质进行多次转化而分离。例如:分离Fe3+和Al3+时,可加入过量的NaOH溶液,生成Fe(OH)3和NaAlO2,过滤后,分别再加盐酸重新生成Fe3+和Al3+。注意转化过程中尽量减少被分离物质的损失.而且转化后的物质要易恢复为原物质。
④酸碱法
被提纯物质不与酸或碱反应,而杂质可与酸或碱发生反应,可用酸或碱作除杂试剂。例如:用盐酸除去 SiO2中的石灰石,用氢氧化钠除去铁粉中的铝粉。
⑤氧化还原法
a.对混合物中混有的还原性杂质,可加入适当的氧化剂将杂质氧化为被提纯物质。例如:将氯水滴入混有FeCl2的FeCl3溶液中,除去FeCl2杂质。
b.对混合物中混有的氧化性杂质,可加入适当还原剂将杂质还原为被提纯物质。例如:将过量铁粉加入混有FeCl3的FeCl2溶液中,振荡过滤,除去FeCl3 杂质。
⑥调节pH法
通过加入试剂来调节溶液的pH,使溶液中某组分沉淀而分离的方法。一般加入相应的难溶或微溶物来调节。例如:在CaCl2溶液中含有FeCl3杂质,由于 Fe3+水解,溶液呈酸性,可采用调节溶液pH的方法将 Fe3+沉淀除去,为此,可向溶液中加氧化钙或氢氧化钙或碳酸钙等。
⑦电解法
此法利用电解原理来分离、提纯物质。例如:电解精炼铜,将粗铜作阳极,精铜作阴极,电解液为含铜离子的溶液,通直流电,在阳极铜及比铜活泼的杂质金属失电子,在阴极只有铜离子得电子析出,从而提纯了铜。
pH的测定:
1.酸碱指示剂法:只能粗略测定溶液的pH范围
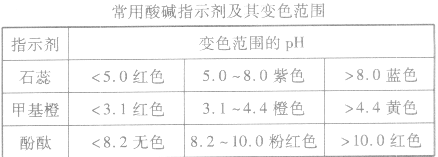
2.pH试纸法:用洁净的玻璃棒蘸取待测溶液点在一小片pH试纸(干燥的)的中部,变色后与标准比色卡对照,读出溶液的pH(粗略的整数值)。
3.pH计法(酸度计):能精确测定溶液的pH(精确到小数点后两位)。
发现相似题
与“下列实验操作中,正确的是( )①.把pH试纸浸入待测溶液中,...”考查相似的试题有:
- 进行化学实验,必须注意实验安全,下列说法错误的是( )A.实验剩余的药品不能放回原瓶,也不能随便丢弃B.不慎将浓碱液沾到...
- (1)点燃不纯的氢气可能会发生爆炸,为了防止意外,可连接一个安全装置。下图的装置能起到此作用的是___________。(2)取一...
- 下列实验操作正确的是
- (3分)下列实验操作中错误的是A.分液时,分液漏斗下层液体从下口放出,上层液体也从下口倒出B.蒸馏时,应使温度计水银球靠...
- (12分)(1)阿司匹林是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135℃。某学习小组在...
- 选用一种试剂能把1mol/L的Na2SO4、Na2SO3、Na2S2O3、Na2CO3、Na2S、BaCl2溶液加以区别,这种试剂是……( )A.CaCl2溶液B.AgN...
- 现有四种无色溶液a,b,c,d,分别是Na2CO3、Na2SO4、H2SO4和Ba(NO3)2中的一种。为确定每种溶液,做如下实验:①a+d→气体+溶液...
- 分离沸点不同但又互溶的液体混合物,常用的方法是 ;分离固液混合物的常用的方法是 ;分离两种溶解度相差很大的溶质的溶液时...
- 欲鉴别物质的量浓度都为0.1 mol·L-1的KCl、(NH4)2SO4、NH3·H2O和H2SO4四瓶无色溶液,下列实验方案最佳的是 ( )。A.用pH...
- 某学生的实验报告中有下列数据,其中合理的有( )A.用托盘天平称取11.7g氯化钠B.用50mL的量筒量取21.48mL盐酸C.用100mL的...