本试题 “铜在自然界存在于多种矿石中,如请回答下列问题:(1)上表所列铜化合物中,铜的质量百分含量最高的是______________。(2)工业上以黄铜矿为原料,采用火法熔炼...” 主要考查您对氧化剂、还原剂
铜盐(二价铜)
二氧化硫
电解精炼铜
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 氧化剂、还原剂
- 铜盐(二价铜)
- 二氧化硫
- 电解精炼铜
(1)定义:得到电子(或电子对偏向)的物质,在反应时所含元素的化合价降低。
(2)常见的氧化剂:
①活泼非金属单质:如 Cl2、Br2、O2等。
②某些高价氧化物,如SO3、MnO2等。
③氧化性含氧酸,如 浓H2SO4、HNO3、HClO等
④元素(如Mn、Cl、Fe等)处于高化合价时的盐,如KMnO4、K2Cr2O7、KClO3、FeCl3等。
⑤过氧化物,如Na2O2、H2O2等。
⑥某些金属阳离子:如Ag+、Fe3+等
还原剂:
(1)定义:失去电子(或电子对偏离)的物质,在反应时所含元素的化合价升高。
(2)常见的还原剂:
①活泼金属单质:如 Na、A1、Zn、Fe等。
②低价态的金属阳离子:如Fe2+等;
③某些非金属单质:如 H2、C等。
④元素(如C、S等)处于低价时的氧化物,如CO、NO、SO2等。
⑤元素(如Cl、S等)处于低化合价时的氢化物:如 H2S、HCl、HI、NH3等 。
⑥元素(如S、Fe等)处于低化合价时的盐或酸,如Na2SO3、H2SO3、H2C2O4、FeSO4等。
常见的氧化剂及对应的还原产物:
|
氧化剂 |
还原产物 |
| Cl2、ClO- | Cl- |
| KMnO4(H+)、MnO2 | Mn2+ |
| HNO3 | NOx、N2、NH4+ |
| 浓H2SO4 | SO2 |
| Ag+、Fe3+ | Ag、Fe2+ |
| H2O2 | H2O |
常见的还原剂及对应的氧化产物:
|
还原剂 |
氧化产物 |
|
Na、K等金属单质 |
Na+、K+ |
|
某些非金属C、S |
CO2、SO2 |
|
非金属的氢化物CH4、H2S、NH3等 |
CO2、S/SO2、NO |
|
某些低价态的氧化物CO、SO2 |
CO2、SO3 |
|
某些低价态的酸或盐H2SO3、Na2SO3等 |
SO42- |
|
某些低价态的阳离子Fe2+ |
Fe3+ |
|
H2O2 |
O2 |
易错易混点:
(1)金属单质只具有还原性,金属最高价阳离子只具有氧化性,处于中间价态的物质既有氧化性,又有还原性;
(2)非金属单质常作氧化剂,某些非金属单质也是较强的还原性物质,比如H2、C等等
(3)元素化合价的变化:
①元素最低价只有还原性,最高价只有氧化性,中间价态既有氧化性又有还原性
②同一元素在反应中化合价发生变化,只能接近不能交叉。
例如: 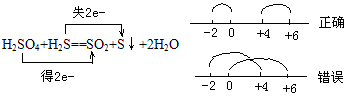
硫酸铜:
五水合硫酸铜(CuSO4·5H2O)为天蓝色晶体,水溶液呈弱酸性,俗名胆矾或蓝矾。硫酸铜是制备其他铜化合物的重要原料。同石灰乳混合可得波尔多液,用作杀菌剂。硫酸铜也是电解精炼铜时的电解液。
硫酸铜的物理性质和化学性质:
(1)物理性质:白色粉末状固体,不溶于乙醇和乙醚,易溶于水,水溶液呈蓝色,是强酸弱碱盐,水溶液呈弱酸性。将硫酸铜溶液浓缩结晶,可得五水硫酸铜蓝色晶体,俗称胆矾、铜矾或蓝矾。
(2)化学性质:
①二价铜与碱反应生成蓝色沉淀Cu(OH)2,Cu(OH)2溶于氨水形成深蓝色溶液[Cu(NH3)4]2+,此性质可以检验Cu2+。无水硫酸铜遇水变成蓝色(CuSO4·5H2O),可作为水的检验的依据。
②胆矾在常温常压下很稳定,不潮解,在干燥的空气中会逐渐风化(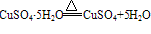 ),加热到45℃时失去2分子结晶水,110℃时失去4分子结晶水,150℃失去全部结晶水。将胆矾加热至650℃高温,可分解为黑色氧化铜、二氧化硫和氧气。
),加热到45℃时失去2分子结晶水,110℃时失去4分子结晶水,150℃失去全部结晶水。将胆矾加热至650℃高温,可分解为黑色氧化铜、二氧化硫和氧气。
(3)Cu2+的化学性质:能被活泼金属将其从盐溶液中置换出来:例:Cu2++Fe==Cu+Fe2+
硫酸铜的用途和制法:
(1)用途:硫酸铜较重要的铜盐之一,在电镀、印染、颜料、农药等方面有广泛的应用。无机农药波尔多液就是硫酸铜和消石灰的混合液,是一种良好的杀菌剂,可防止多种作物的病害。硫酸铜也常用来制备其他铜的化合物和电解精炼铜的电解液。
(2)制法:五水合硫酸铜可由铜或氧化铜与硫酸作用后,浓缩结晶而制得。在实验室中可用浓硫酸氧化金属铜来制取无水硫酸铜。
①化学式:SO2
②分子结构:SO2是由极性键形成的极性分子,因此易溶于水,其晶体为分子晶体。
二氧化硫的物理性质和化学性质:
1.物理性质:
SO2是无色、有刺激性气味的有毒气体,密度比空气大,易溶于水(常温常压下,1体积水大约溶解40体积的SO2),易液化(沸点-10℃)。
2.化学性质
(1)具有酸性氧化物的通性
①将SO2通入紫色石蕊试液中,试液变红。
②能与碱性氧化物、碱及某些盐反应。如:
(2)还原性 

(3)弱氧化性 
(4)漂白性(不能漂白酸碱指示剂) 能和某些有色物质化合生成无色物质,生成的无色物质不稳定,易分解而恢复原色,因此,SO2的漂白并不彻底。在中学化学常见试剂中,能用SO2漂白的只有品红溶液,品红溶液 无色溶液
无色溶液 恢复原色。
恢复原色。
SO2与一些物质反应的实验现象:


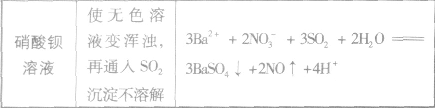
SO2与强碱反应后固体成分的确定:
SO2与强碱(如NaOH)溶液发生反应后的固体成分取决于二者的用量。遇到类似的问题,可以采用数轴分析法讨论。设SO2的物质的量为n(SO2),NaOH物质的量为n(NaOH),数轴代表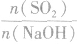 ,如下数轴所示:
,如下数轴所示: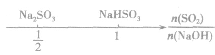
分析数轴可得:
(1)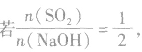 则固体物质为Na2SO3,
则固体物质为Na2SO3,
(2)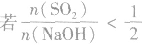 ,则固体物质为NaOH 和Na2SO3.
,则固体物质为NaOH 和Na2SO3.
(3)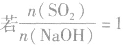 ,则同体物质为NaHSO3
,则同体物质为NaHSO3
(4)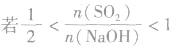 ,则固体物质为Na2SO3和NaHSO3,
,则固体物质为Na2SO3和NaHSO3,
(5)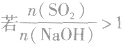 ,则固体物质为NaHSO3。
,则固体物质为NaHSO3。
二氧化硫的制备:
工业制法:

实验室制法:
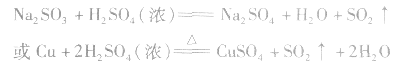
(1)收集:向上排空气法。
(2)检验:品红溶液。SO2是中学阶段学到的唯一种既能使品红褪色,加热后又能使其恢复原色的气体。
(3)尾气处理:用NaOH溶液吸收。
二氧化硫的用途:
工业上用二氧化硫漂白纸浆、毛、丝、草编制品等。此外,二氧化硫还可用于杀菌消毒,可以用作防腐剂。
二氧化硫对环境的污染及治理:

精炼铜:
(1)要求
(2)反应原理如下图所示: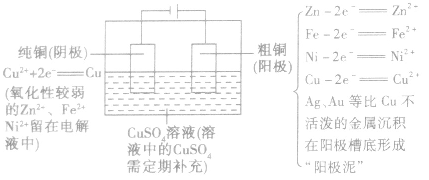
与“铜在自然界存在于多种矿石中,如请回答下列问题:(1)上表所列...”考查相似的试题有:
- 据最新报道,科学家发现了如下反应:O2+PtF6=O2(PtF6),已知O2(PtF6)为离子化合物,其中Pt的化合价为+5,对于此反应,下列说...
- 下列反应中,通入的气体物质只作为氧化剂的是[ ]A.二氧化硫通入氢硫酸中B.氯气通入NaOH溶液中C.少量氯气通入氯化亚铁酸性...
- 钢铁“发蓝”是指在钢铁的表面形成一层四氧化三铁的技术过程。化学方程式①②③表示钢铁“发蓝”的变化原理下列说法不正确的是[ ]①3F...
- 某兴趣小组在实验室用铜和硫酸为原料,采用多种方法制取硫酸铜。制备方法如下:方法一(1)浓硫酸试剂瓶上适合贴上的标签是____...
- 煤是重要的化工原料,用煤作燃料,不仅存在浪费,而且因烟煤中含有硫的化合物(如FeS2),燃烧时会生成SO2气体造成环境污染。...
- 鉴别纯碱、石灰石、芒硝、石膏四种固体物质,下列试剂中应该选用( )A.NaOH溶液B.水、盐酸C.硝酸溶液D.BaCl2和HNO3的混合液
- 下列反应的现象均是溶液褪色,问其中能体现二氧化硫有漂白性的是( )A.将SO2气体通入含有氢氧化钠的酚酞溶液中,溶液褪色B...
- W、X、Y、Z是原子序数依次增大的同一短同期的元素,W、X是金属元素,Y、Z是非金属元素。回答下列问题:(1)W、X对应的最高价氧...
- 下列叙述正确的是[ ]A.硅可作半导体材料,是光导纤维的主要成分B.常温下浓硝酸与铁不反应,可用铁桶贮运浓硝酸C.将CO2通入...
- 下列有关事实或现象的解释正确的是[ ]A. SO2气体能使品红和酸性高锰酸钾溶液褪色,且原理相同B. 氨气在一定条件下可将NO2转化...