本试题 “中学化学教材中提供了不少数据。下列为某同学利用相关数据作出推理和判断的依据,其中不正确的是[ ]A.依据中和热的数据,推算一定量的H2SO4和NaOH的稀溶液反...” 主要考查您对键能、键长、键角
中和热
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 键能、键长、键角
- 中和热
共价键的键参数:
(1)键能:指气态基态原子形成1mol化学键释放的最低能量。键能越大,化学键越稳定。
(2)键长:指成键原子的核间距。键长越短,共价键越稳定。
注意:我们通常通过比较两原子的共价半径来比较共价单键键长的大小,但共价键的键长并不等于两原子的共价半径之和。
(3)键角:在多原子分子内,两个共价键之间的夹角。
键角是描述分子立体结构的重要参数。多原子分子的键角是一定的,表明共价键具有方向性。

说明:键长、键能决定共价键的强弱和分子的稳定性。原子半径越小,键长越短,键能越大,分子越稳定。例如, 分子中:
分子中:
X原子半径: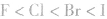
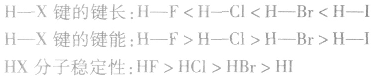
(1)键能:指气态基态原子形成1mol化学键释放的最低能量。键能越大,化学键越稳定。
(2)键长:指成键原子的核间距。键长越短,共价键越稳定。
注意:我们通常通过比较两原子的共价半径来比较共价单键键长的大小,但共价键的键长并不等于两原子的共价半径之和。
(3)键角:在多原子分子内,两个共价键之间的夹角。
键角是描述分子立体结构的重要参数。多原子分子的键角是一定的,表明共价键具有方向性。

说明:键长、键能决定共价键的强弱和分子的稳定性。原子半径越小,键长越短,键能越大,分子越稳定。例如,
 分子中:
分子中: X原子半径:
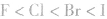
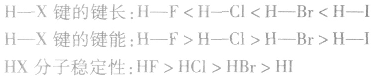
中和热:
在稀溶液中,酸和碱发生中和反应生成1molH2O时的反应热。中和热的表示方法: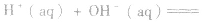
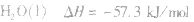
在稀溶液中,酸和碱发生中和反应生成1molH2O时的反应热。中和热的表示方法:
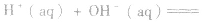
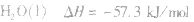
影响中和热测定的因素:
中和反应巾放出的热量为(m1+m1)·c·(t1-t2),其巾溶液的比热容c是已知的,对于给定的反应物的质量m1和m2也是定值,这样求算出的中和热是否接近 57.3kl·mol-1,取决于溶液温度的变化。
在整个实验过程中应把好两关:①隔热关。如:小烧杯周围的泡沫塑料要填满;盖板上两孔只要正好使温度计和环形玻璃搅拌棒通过即可;倒人NaOH溶液要迅速等,尽可能减少实验过程中热量的散失。②准确关。如:配制溶液的浓度要准;NaOH溶液要新制,因为久置的NaOH溶液可能变质导致浓度不准;量取液体体积时读数要准;对溶液温度要读到最高点。
注意事项:
(1)这里的溶液一般要求是稀溶液,这是因为浓酸溶液和浓碱溶液相互稀释时会放出热量
(2)强酸与强碱的反应实质是H+和OH-反应(即与酸、碱的种类无关),通过多次实验测定,1molH+和1molOH-反应生成lmol H2O(l)时,放出的热量为 57.3kJ
(3)中和热是以生成1molH2O为基准的,因此表示中和热的热化学方程式中,水的化学计量数为1,酸、碱的化学计量数可以为分数
发现相似题
与“中学化学教材中提供了不少数据。下列为某同学利用相关数据作...”考查相似的试题有:
- 根据下表中所列键能数据,判断下列分子中,最不稳定的分子是( )化学键H-HH-ClH-ICl-ClBr-Br键能/kJ•mol-1436431299247193A...
- 关于键长、键能和键角,下列说法不正确的是[ ]A.键角是确定多分子立体结构(分子形状)的重要参数B.通过反应物和生成物分子...
- 化学反应N2+3H2===2NH3的能量变化如右图所示,该反应的热化学方程式是A.N2(g)+3H2(g)===2NH3(l) ΔH=2(a-b-c)kJ·mol-B...
- 下列叙述中,正确的是( )A.甲烷的标准燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g) + 2O2(g) ="=="...
- 在25℃、1.01×105Pa下,将22gCO2通入到750mL 1.0mol·L-1的NaOH溶液中充分反应,放出xkJ热量。在该条件下1molCO2通入到2L 1.0mo...
- (6分)(1)某反应过程中的能量变化如下图所示:写出该反应的热化学方程式_____________________________________________。(2)...
- 甲醇是一种重要的化工原料。甲醇与水蒸气催化重整可获得清洁能源,具有广泛的应用前景。现有如下实验,在体积为1 L的密闭容器...
- 1g氢气完全燃烧生成液态水放出142.9kJ的热量, 表示该反应的热化学方程式中, 正确的是A.2 H2(g) + O2(g) =" 2" H2O(l);△H=-...
- 在25 ℃、101 kPa下,1 g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68 kJ。下列热化学方程式正确的是( )A.CH3OH(l)+3/2O2(g)=...
- 下列依据热化学方程式得出的结论正确的是( )A.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.3 kJ•mol-1,则含40.0...