本试题 “请回答下面问题(1)Mg是第三周期元素,该周期部分元素氟化物的熔点见下表解释表中氟化物熔点差异的原因:____________________________________(2)CO的结...” 主要考查您对离子晶体
键能、键长、键角
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 离子晶体
- 键能、键长、键角
离子晶体:
离子间通过离子间结合而形成的晶体,熔点较高、沸点高,导热性、延展性不良,固态不导电、熔融或溶于水导电,脆而硬,如:NaCl
离子间通过离子间结合而形成的晶体,熔点较高、沸点高,导热性、延展性不良,固态不导电、熔融或溶于水导电,脆而硬,如:NaCl
晶体的基本类型与性质:

晶体类型的判断方法:
1.依据晶体的组成微粒与微粒间作用力来判断
离子晶体的组成微粒是阴、阳离子,微粒间作用力是离子键;原子晶体的组成微粒是原子,微粒间作用力是共价键;分子晶体的组成微粒是分子,微粒间作用力是分子间作刚力;金属晶体的组成微粒是金属阳离子和自南电子,微粒间作用力是金属键。
2.依据物质的分类判断
金属氧化物(如K2O、Na2O等)、强碱(如NaOH、 KOH等)和绝大多数的盐是离子晶体。大多数非金属单质(除金刚石、石墨、品体硅、晶体硼以外)、气态氢化物、非金属氧化物(除SiO2以外)、酸、绝大多数有机物 (除有机盐以外)都是分子晶体。常见的属于原子晶体的单质有金刚石、晶体硅、晶体硼、晶体锗等,常见的属于啄子品体的化合物有碳化硅(SiC)、氮化硅(Si3N4)、氮化硼(BN)、二氧化硅(SiO2)等。金属单质与合金是金属晶体.
3.依据晶体的熔点判断
离子晶体熔点较高,常在几百至一千摄氏度。原子晶体熔点高,常在一千至几千摄氏度。分子晶体熔点低,常在几百摄氏度以下至很低的温度。金属晶体的熔点范围最广,钨的熔点比部分原子晶体还要高,汞的熔点比部分分子晶体还要低。
4.依据导电性判断离子晶体水溶液及熔化时能导电、原子晶体一般为非导体。分子晶体为非导体,但分子晶体中的电解质溶于水,使分子内的化学键断裂形成自由离子也能导电。金属晶体是电的良导体。
5.依据硬度和机械性能判断
离子晶体硬度大(或硬而脆);分子晶体硬度较小;原子晶体硬度大;金属晶体多数硬度大,但也有较小的,具有延展性。
共价键的键参数:
(1)键能:指气态基态原子形成1mol化学键释放的最低能量。键能越大,化学键越稳定。
(2)键长:指成键原子的核间距。键长越短,共价键越稳定。
注意:我们通常通过比较两原子的共价半径来比较共价单键键长的大小,但共价键的键长并不等于两原子的共价半径之和。
(3)键角:在多原子分子内,两个共价键之间的夹角。
键角是描述分子立体结构的重要参数。多原子分子的键角是一定的,表明共价键具有方向性。

说明:键长、键能决定共价键的强弱和分子的稳定性。原子半径越小,键长越短,键能越大,分子越稳定。例如, 分子中:
分子中:
X原子半径: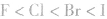
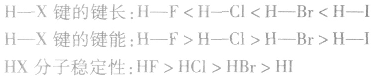
(1)键能:指气态基态原子形成1mol化学键释放的最低能量。键能越大,化学键越稳定。
(2)键长:指成键原子的核间距。键长越短,共价键越稳定。
注意:我们通常通过比较两原子的共价半径来比较共价单键键长的大小,但共价键的键长并不等于两原子的共价半径之和。
(3)键角:在多原子分子内,两个共价键之间的夹角。
键角是描述分子立体结构的重要参数。多原子分子的键角是一定的,表明共价键具有方向性。

说明:键长、键能决定共价键的强弱和分子的稳定性。原子半径越小,键长越短,键能越大,分子越稳定。例如,
 分子中:
分子中: X原子半径:
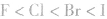
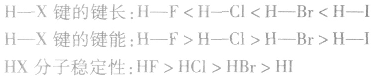
发现相似题
与“请回答下面问题(1)Mg是第三周期元素,该周期部分元素氟化物...”考查相似的试题有:
- 下列叙述不正确的是[ ]A.含有非极性键的分子都是非极性分子B.完全由极性键形成的分子不一定是极性分子C.由共价键结合而成...
- 下列图式正确的是( ) A.氟化氢的电子式: B.次氯酸的结构式:H-Cl-O C.铝离子的结构示意图 D.氯化铯的晶体结构(晶胞)...
- 下列的晶体中,化学键种类相同,晶体类型也相同的是[ ]A.SO2与SiO2B.CO2与H2OC.NaCl与HClD.CCl4与KCl
- 下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是[ ]A.SiO2和SO2B.CO2和H2OC.NaCl和HClD.CCl4和KCl
- 氯化钠是日常生活中人们常用的调味品。下列性质可以证明氯化钠中一定存在离子键的是[ ]A.具有较高的熔点B.熔融状态能导电C...
- 下面有关晶体的叙述中,不正确的是[ ]A.金刚石空间网状结构中,由共价键形成的碳原子环中,最小环上有6个碳原子B.氯化钠晶...
- 下列说法正确的是[ ]A.Na2O2晶体中阴离子和阳离子的数目之比为1:1B.只有非金属元素之间才能形成共价键C.分子晶体中不一定...
- 下列分子中,键角最大的是[ ]A.H2SB.H2OC.CCl4D.NH3
- 碳化硅(SiC)的一种晶体具有类似金刚石的结构,其中碳原子和硅原子的位置是交替的。在下列三种晶体①金刚石、②晶体硅、③碳化硅...
- 氮化硼(BN)是一种重要的功能陶瓷材料以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示:(1)由B2O3制备BF3、...