本试题 “某种待测浓度的NaOH溶液25mL,加入20mL 1mol•L-1的H2SO4溶液后显酸性,再滴入0.5mol•L-1K2CO3溶液1.5mL恰好能与H2SO4反应完全(假设K2CO3只转化为CO2).则:...” 主要考查您对化学反应方程式
电离方程式
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 化学反应方程式
- 电离方程式
化学方程式:
用化学式来表示化学反应的式子,叫做化学方程式。化学方程式不仅表明了反应物、生成物和反应条件,同时,通过相对分子质量或相对原子质量还可以表示个物质之间的质量关系,即各物质之间的质量比。
书写化学方程式要遵守两个原则:
一是必须以客观事实为基础,绝不能凭空臆想、臆造事实上不存在的物质和化学反应;
二是要遵守质量守恒定律,等号两边各原子种类与数目必须相等。
化学方程式的意义:
化学方程式不仅表明了反应物、生成物和反应条件。同时,化学计量数代表了各反应物、生成物物质的量关系,通过相对分子质量或相对原子质量还可以表示各物质之间的质量关系,即各物质之间的质量比。对于气体反应物、生成物,还可以直接通过化学计量数得出体积比。
定义:
表示电解质电离的式子。强电解质电离用“=”,弱电解质电离用“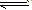 ” 。
” 。
.
表示电解质电离的式子。强电解质电离用“=”,弱电解质电离用“
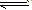 ” 。
” 。.
电离方程式的书写:
1.强电解质的电离用“ ”,弱电解质的电离用 “
”,弱电解质的电离用 “ ”。
”。
2.多元弱酸分步电离,分步持写电离方程式,一般只写第一步;多元弱碱也是分步电离的,但可按一步完全电离写出。例如:
氧硫酸: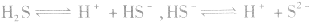
氢氧化铁:
3.强酸的酸式盐完全电离,弱酸的酸式盐中酸式酸根不完全电离。例如: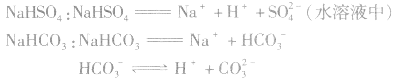
说明:在熔融状态时,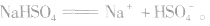
4.某些复盐能完全电离。例如:
发现相似题
与“某种待测浓度的NaOH溶液25mL,加入20mL 1mol•L-1的H2SO4溶液...”考查相似的试题有:
- 含有1mol HNO3的稀硝酸分别与不同质量的铁粉,所得氧化产物a、b与铁粉物质的量关系如图所示.下列有关判断正确的是( )A.a...
- 一块表面已被氧化为Na2O的钠块7.7g,将其投入100g水中,产生H20.2g,则被氧化的钠是( )A.9.2gB.10.6gC.6.2gD.2.3g
- 实验室常用铁屑和稀硫酸制备氢气.经测定,将28g纯铁投入100ml某稀硫酸,恰好完全反应.求该稀硫酸的物质的量浓度以及产生氢...
- 将一定量的锌与100mL 18.5mol/L浓硫酸充分反应后,锌完全溶解,同时生成气体A 33.6L(标准状况).将反应后的溶液稀释至1L,...
- 煤的“气化”是使煤变成清洁能源的有效途径之一,其主要反应为:C+H2O=CO+H2 .甲酸苯丙酯(F)是生产香料和药物的主要原料....
- 含有0.20molNa2CO3的溶液120mL和200mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体...
- 波尔多液农药不能用铁制容器盛放,是因为铁能与农药中的硫酸铜起反应,请写出反应的化学方程式______,并指明氧化剂______,...
- Ⅰ.现有m g某气体X2,它的摩尔质量为M g•mol-1.若阿伏加德罗常数用NA表示,则:(1)该气体的物质的量为______mol.(2)该...
- 按下列要求填写化学用语:(1)Ba(OH)2溶于水时的电离方程式:_____________________(2)氯化铵与浓的氢氧化钠溶液混合加热...
- 已知100mL 0.1mol•L-1的NaHSO4溶液中H+的物质的量浓度为0.1mol•L-1,请回答下列问题:(1)写出NaHSO4在水溶液中电离的方程式...