本试题 “(I)多项选择题CH3+、CH3-、CH3-都是重要的有机反应中间体,有关它们的说法正确的是_______。A.它们均由甲烷去掉一个氢原子所得B.它们互为等电子体,碳原子...” 主要考查您对杂化轨道理论(中心原子杂化方式)
晶胞
元素周期表
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 杂化轨道理论(中心原子杂化方式)
- 晶胞
- 元素周期表
是鲍林为了解释分子的立体结构提出的。中心原子杂化轨道、孤电子对数及与之相连的原子数间的关系是:杂化轨道数=孤电子对数+与之相连的原子数。杂化前后轨道总数比变,杂化轨道用来形成σ键或容纳孤对电子,未杂化的轨道与杂化轨道所在平面垂直,可用来形成π键。
常见杂化方式:
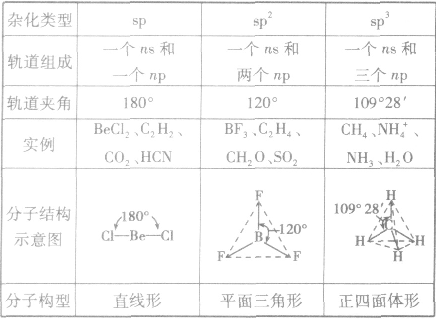
(1)sp杂化:直线型 如:CO2、CS2
(2)sp2杂化:平面三角形(等性杂化为平面正三角形) 如:BCl3 C2H4
不等性杂化为V字型 如:H2O H2S OF2
(3)sp3杂化:空间四面体(等性杂化为正四面体) 如:CH4、CCl4
不等性杂化为三角锥 如:NH3 PCl3 H3O+
sp3d杂化:三角双锥
sp3d2杂化:八面体(等性杂化为正八面体)
分子的构型与杂化类型的关系:
晶胞:
1.定义描述晶体结构的基本单元叫做晶胞。
2.结构一般来说,晶胞为平行六面体,晶胞只是晶体微观空间里的一个基本单元,在它的上、下、左、右、前、后无隙并置地排列着无数晶胞,而且所有晶胞的形状及其内部的原子种类、个数及几何排列是完全相同的。“无隙”是指相邻晶胞之间没有任何间隙,“并置”是指所有晶胞都是平行排列的,取向相同。
晶胞中微粒数目的确定:
计算晶胞中微粒数目的常用方法是均摊法。均摊法是指每个晶胞平均拥有的粒子数目。如某个粒子为n个晶胞所共有,则该粒子有 属于这个晶胞。
属于这个晶胞。
(1)长方体(或正方体)形晶胞中不同位置的粒子数的计算。
①处于顶点的粒子,同时为8个晶胞所共有,每个粒子有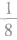 属于该晶胞。
属于该晶胞。
②处于棱上的粒子,同时为4个晶胞所共有,每个粒子有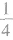 属于该晶胞。
属于该晶胞。
③处于面上的粒子,同时为2个晶胞所共有。每个粒子有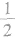 属于该晶胞。
属于该晶胞。
④处于晶胞内部的粒子,则完全属于该晶胞。
(2)非平行六面体形晶胞中粒子数目的计算同样可用均摊法,其关键仍然是确定一个粒子为几个晶胞所共有。例如,石墨晶胞每一层内碳原子排成许多个六边形,其顶点(1个碳原子)对六边形的贡献为 ,那么每一个六边形实际有6×
,那么每一个六边形实际有6× =2个碳原子。
=2个碳原子。
(3)在六棱柱晶胞(如图所示 MgB2的晶胞)中,顶点上的原子为6 个晶胞(同层3个,上层或下层3个) 共有,面上的原子为2个晶胞共有,因此镁原子个数为12×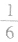 +2×
+2×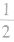 =3,硼原子个数为6。
=3,硼原子个数为6。 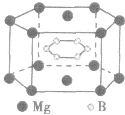
特别提醒:在晶胞中微粒个数的计算过程中,不要形成思维定式,不同形状的晶胞应先分析任意位置上的一个粒子被几个晶胞共用,如六棱柱晶胞中,顶点、侧棱、底面上的棱、面心上的原子依次被6、3、4、2 个晶胞共用。
有关晶胞密度的计算步骤:
①根据“分摊法”算出每个晶胞实际含有各类原子的个数,计算出晶胞的质量m:
②根据边长计算晶胞的体积V:
③根据 进行计算,得出结果。
进行计算,得出结果。
元素周期表编排原则:
(1)把电子层数相同的各种元素按原子序数递增的顺序从左至右排成横行。
(2)把最外层电子数相同的元素按电子层数递增的顺序由上到下排列成纵行。
注意:①元素周期表是元素周期律的具体表现形式,它反映了元素之间相互联系的规律。
②历史上第一个元素周期表是1869年俄国化学家门捷列夫在前人探索的基础上排成的,他将元素按相对原子质量由小到大依次排列,并将化学性质相似的元素放在一个纵行。
元素周期表的结构:
(1)周期
①周期的含义在元素周期表中,把电子层数相同的元素,按原子序数递增的顺序从左到右排成横行,这样每个横行为一个周期。现在使用的元素周期表有7个横行,即7 个周期。
②周期的划分
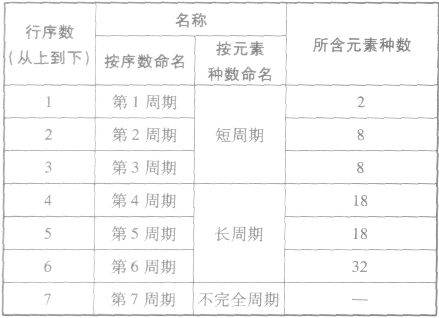
(2)族
①族的含义在周期表中,把不同横行(即周期)中最外层电子数相同的元素,按电子层数递增的顺序由上到下排成纵行,除第8、9、10三个纵行叫做第Ⅷ族外,其余15个纵行,每个纵行为一族。现在使用的元素周期表有18 个纵行,它们被划分为16个族。
②族的划分
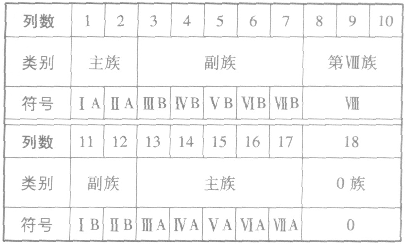
(3)元素周期表中主族元素金属性和非金属性的递变
与“(I)多项选择题CH3+、CH3-、CH3-都是重要的有机反应中间体,有...”考查相似的试题有:
- 2008年的秋天,毒奶粉事件震惊全国,这主要是奶粉中含有有毒的三聚氰胺(分子结构如下图所示)。下列关于三聚氰胺分子的说法...
- 已知次氯酸分子的结构式为H-O-Cl,下列有关说法正确的是[ ]A.O原子发生sp杂化B.O原子与H、Cl都形成σ键C.该分子为直线型分...
- 某晶体的一部分如下图所示,这种晶体中A、B、C三种粒子数之比是( )A.3∶9∶4 B.1∶4∶2 C.2∶9∶4 D.3∶8∶4
- X、Y均为元素周期表中前20号元素,其简单离子的电子层结构相同,下列说法正确的是[ ]A.由mXa+与nYb-,得m+a=n-bB.X2-的还...
- 下列比较关系中,错误的是( )A.元素金属性Na>Mg>AlB.热稳定性H2S>HCl>HFC.酸性:H3PO4<H2SO4<HClO4D.原子半径Na...
- A,B,C是相邻的3种元素,A,B同周期,B,C同主族,且3种元素的质子数总和为30,写出这3种元素的名称_________________________
- 2006年10月22号,就近日日本SK-Ⅱ品牌的9种化妆品被检出含有禁用物质铬(Cr)和钕(Nd)一事,日本驻中国大使馆在北京召开新闻...
- 根据元素周期表,判断下列元素中不属于主族元素的是( )A.钙B.铁C.磷D.碘
- 下表是元素周期表的一部分.表中所列的字母分别代表某一化学元素.bhjacfilmegdk(1)下列______(填写编号)组元素的单质可...
- 下列化学用语或模型图不正确的是( )A.HCN的结构式为H-C≡NB.Na2O2的电子式:C.具有16个质子、16个中子和18个电子的微粒是...