本试题 “类推的思维方法在化学学习与研究中经常用到,但有时会产生错误的结论。因此,推出的结论最终要经过实践的检验才能决定其是否正确。以下几种类推结论中,不正...” 主要考查您对灭火的原理和方法
化学式的写法和意义
金属的冶炼(铁的冶炼)
物质的相互转化和制备
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 灭火的原理和方法
- 化学式的写法和意义
- 金属的冶炼(铁的冶炼)
- 物质的相互转化和制备
破坏燃烧的条件,即可达到灭火的目。
①清除可燃物或使可燃物与其他物品隔离;②隔绝氧气(或空气);③使可燃物的温度降到着火点以下。破坏燃烧的三个条件中任何一个即可达到灭火的目的。
灭火原理的实验探究:
| 实验方案 | 现象 | 分析 |
点燃三支蜡烛,在其中一支蜡烛上扣一只烧杯.将另两支蜡烛放在烧杯中,然后向其中只烧杯中加适量碳酸钠和稀盐酸如下图: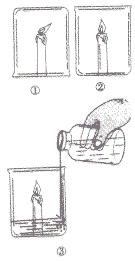 |
①在倒扣烧杯中的蜡烛熄灭 ②正放在烧杯中的蜡烛正常燃烧 ③加入适量碳酸钠和稀盐酸的烧杯中的蜡烛很快熄灭 |
①在倒扣烧杯中的蜡烛因钮气不足而熄灭 ②正放存烧杯中的蜡烛与氧气接触,温度保持在蜡烛的着火点以上,因此能正常燃烧 ⑧稀盐酸与碳酸钠迅速反应产生大量的二氧化碳气体,二氧化碳既不燃烧也不支持燃烧,所以蜡烛很快熄灭。 |
灭火方法:
①将可燃物撤离燃烧区.与火源隔离.如液化气、煤气起火,首先要及时关闭阀门,以断绝可燃物的来源;扑灭森林火灾,可用设置隔离带的方法使森林中的树木与可燃烧区隔离
②将燃着的可燃物与空气隔离,如厨房油锅起火,盖上锅盖就能灭火;二氧化碳灭火器能火火的原因之一是灭火器喷出的大量二氧化碳在燃烧物表面形成一层二氧化碳气体层,使燃烧物与在空气隔绝,达到灭火的目的
③用大量的冷却剂(如水、干冰等)冷却可燃物,使温度降低到可燃物的着火点以下,如建筑物起火时,用高压水枪灭火等。
易错点:
灭火时降低温度不是降低着火点,着火点是物质的固有属性,一般情况下不能改变。
几种常见灭火器的灭火原理和适用范围:
| 灭火器 | 灭火原理 | 适用范围 |
| 泡沫灭火器 | 灭火时.能喷射出大量二氧化碳及泡沫,它们能黏附在可燃物上,使可燃物与空气隔绝,达到灭火的目的 | 可用来扑灭木材、棉布等燃烧引起的灭火 |
| 利用压缩的二氧化碳吹出干粉(主要含有碳酸氧钠)来灭火 | 具有流动性好,喷射率高、不腐蚀容器和不易变质等优良性能,除可用来扑灭一般失火外,还可用来扑灭油、气等燃烧引起的失火 | |
| 在加压时将液态二氧化碳压缩在小钢瓶中,灭火时再将其喷出,有降温和隔绝空气的作用 | 火火时不会因留下任何痕迹而使物体损坏.因此可用来扑灭图书、档案、贵重设备、精密仪器等处的失火.使用时,手一定要先握在钢瓶的木柄上,否则.会把手冻伤。 |
泡沫灭火器的灭火原理:
1. 泡沫灭火器的灭火原理:
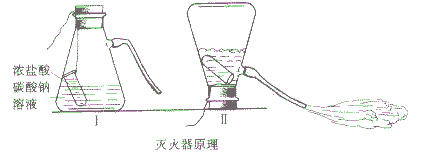
现象:当把吸滤瓶倒置后,浓HCl与Na2CO3溶液剧烈反应,产生大量CO2气体夹带着水从导管喷出。
方程式:Na2CO3+HCl==2NaCl+H2O+CO2↑(泡沫灭火原理)
2. 实际使用的泡沫灭火器,常用硫酸铝来代替盐酸(或硫酸),用碳酸氢钠来代替碳酸钠,为了产生泡沫,常放入甘草或皂角等原来制取液体。把泡沫灭火器倒转时,两种药液相互混合,发生如下反应:Al2(SO4)2+6NaHCO3==3Na2SO4+2Al(OH)3↓+6CO2↑
大量的二氧化碳跟发泡剂形成泡沫,从喷嘴中喷射出来,覆盖在燃烧物上,使燃烧物隔绝空气和降低温度,达到灭火的目的。但是,因为泡沫中含有水分,不宜用于扑救遇水发生燃烧或爆炸的物质(如钾、钠、电石等)引起的火灾;对于电器火灾,要在切断电源后才能使用泡沫灭火器。
用元素符号和数字的组合表示物质组成的式子,叫做化学式。如可用O2,H2O,MgO分别表示氧气、水、氧化镁的化学式。
对概念的理解:
(1)混合物不能用化学式表示,只有纯净物才能用化学式表示。
(2)每一种纯净物只有一个化学式,但一个化学式有可能用来表示不同的物质。如氧气的化学式是O2,没有别的式子再能表示氧气;P既是红磷的化学式,也是白磷的化学式。
(3)纯净物的化学式不能臆造,化学式可通过以下途径确定:
①科学家通过进行精确的定量实验,测定纯净物中各元素的质量比,再经计算得出。
②已经确定存在的物质可根据化合价写出。
书写规则:
1.单质化学式的写法:
首先写出组成单质的元素符号,再在元素符号右下角用数字写出构成一个单质分子的原子个数。稀有气体是由原子直接构成的,通常就用元素符号来表示它们的化学式。金属单质和固态非金属单质的结构比较复杂,习惯上也用元素符号来表示它们的化学式。
2.化合物化学式的写法:
首先按正前负后的顺序写出组成化合物的所有元素符号,然后在每种元素符号的右下角用数字写出每个化合物分子中该元素的原子个数。一定顺序通常是指:氧元素与另一元素组成的化合物,一般要把氧元素符号写在右边;氢元素与另一元素组成的化合物,一般要把氢元素符号写在左边;金属元素、氢元素与非金属元素组成的化合物,一般要把非金属元素符号写在右边。直接由离子构成的化合物,其化学式常用其离子最简单整数比表示。
化学式的读法:
一般是从右向左叫做“某化某”,如“CuO”叫氧化铜。当一个分子中原子个数不止一个时,还要指出一个分子里元素的原子个数,如“P2O5”叫五氧化二磷。有带酸的原子团要读成“某酸某”如“CuSO4”叫硫酸铜,还有的要读“氢氧化某”,如“NaOH”叫氢氧化钠。“氢氧化某”是碱类物质,电离出来的负电荷只有氢氧根离子。
化学式的意义:
(1)由分子构成的物质
| 化学式的含义 | 以H2O为例 | ||
| 质的含义 | 宏观 | ①表示一种物质 ②表示物质的元素组成 |
①表示水 ②表示水是由氢、氧两种元素组成的 |
| 微观 | ①表示物质的一个分子 ②表示组成物质每个分子的原子种类和数目 ③表示物质的一个分子中的原子总数 |
①表示一个水分子 ②表示一个水分子是由两个氧原子和一个氧原子构成的 ③表示一个水分子中含有三个原子 | |
| 量的含义 | ①表示物质的相对分子质量 ②表示组成物质的各元素的质量比 ③表示物质中各元素的质量分数 |
①H2O的相对分子质R =18 ②H2O中氢元素和氧元素质量比为1:8 ③H2O中氢元素的质量分数= 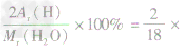 100%=11.1% 100%=11.1% | |
(2)由原子构成的物质(以Cu为例)
宏观:
表示该物质:铜
表示该物质由什么元素组成:铜由铜元素组成
微观:表示该物质的一个原子—一个铜原子。
化学式和化合价的关系:
(1)根据化学式求化合价
①已知物质的化学式,根据化合价中各元素的正负化合价代数和为0的原则确定元素的化合价。
标出已知、未知化合价: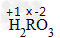
列出式子求解:(+1)×2+x×1+(-2)×3=0 x=+4
②根据化合价原则,判断化学式的正误,如判断化学式KCO3是否正确
标出元素或原子团的化合价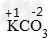
计算正负化合价代数和是否为0:(+1)×1+(-2)×1=-1≠0,所以给出的化学式是错误的,正确的为K2CO3。
③根据化合价原则,计算原子团中某元素的化合价,如计算NH4+中氮元素的化合价和H2PO4-(磷酸二氢根)中磷元素的化合价。
由于NH4+带一个单位的正电荷,不是电中性的,因此各元素的化合价代数和不为多,而是等于+1. 设氮元素的化合价为x
x+(+1)×4=+1 x=-3
所以在NH4+中,氮元素的化合价为-3. 同理H2PO4-带一个单位的负电荷、不是电中性的、因此各元素的化合价代数和不为零,而是-1.
设磷元素的化合价为y
(+1)×2+y+(-2)×4=-1 y=+5 所以在H2PO4-中磷元素的化合价为+5.
④根据化合价原则,确定物质按化合价的排序。如H2S,S,SO2,H2SO4四种物质中均含有硫元素,并且硫元素的化合价在四种物质中分别为:-2,0, +4,+6,故这四种物质是按硫元素的化合价由低到高的顺序排列的。
(2)根据化合价写化学式
根据化合物中化合价的代数和等于0的原则,已知元素的化合价可以推求实际存在物质的化学式,主要方法有两种:
①最小公倍数法
| 步骤 | 举例 | |
| 写 | 一般把正价元素的符号(或原子团)写在左边,负价元素的符号(或原子团)写在右边,并把化合价写在元素符号(或原子团)的正上方 | 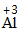 、 、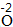 |
| 求 | 求出两种元素化合价绝对位的最小公倍数,然后求出每种元素的原子个数= |
因为|-2|×|+3|=6,所以Al原子个数为6/3=2,O原子个数=6/2=3 |
| 标 | 将原子个数写在相应元素符号的正下角 | Al2O3 |
| 验 | 检验各种元素正负化合价的代数和是否为0,确定化学式的正确性 | (+3)×2+(-2)×3=0,所以该化学式正确。 |
| 步骤 | 例1 硫酸铜 | 例2 氧化钙 | |
| 排列 | 分析名称,确定元素符号(或原子团)的顺序 | 铝 硫酸根 Al SO4 |
钙 氧 Ca O |
| 标价 | 标上化合价 | 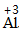 、 、 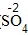 |
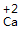 、 、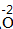 |
| 约简 | 将化合价的绝对值约成最简整数比 |  、 、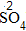 |
 、 、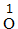 |
| 交叉 | 将整数交叉写在元素符号(或原子团)的右下角 |  |
 |
| 检验 | 根据正负化合价代数和是否为0,检验正误 | (+3)×2+(-2)×3=0 | (+2)+(-2)=0 |
确定化学式的几种方法:
1. 根据化合价规则确定化学式
例1:若A元素的化合价为+m,B元素的化合价为-n,已知m与n都为质数,求A,B两元素化合后的物质的化学式。
解析:由题意知正、负化合价的最小公倍数为m ·n,A的原子个数为(m·n)/m=n,B的原子个数为 (m·n)/n=m
答案:所求化学式为AnBm.
2. 根据质量守恒定律确定化学式
例2:根据反应方程式2XY+Y2==2Z,确定Z 的化学式
解析:根据质量守恒定律,反应前后原子种类不变,原子数目没有增减,反应前有两个X原子,四个Y原子,则两个Z分子含有两个X原子和四个Y原子。
答案:z的化学式为XY2
3. 利用原子结构特征确定化学式
例3:X元素的原子核外有17个电子,Y元素的原子最外层有2个电子,求X、Y两元素所形成的化合物的化学式。
解析:X元素的原子核外有17个电子,Y元素的原子最外层有2个电子,X原子易得1个电子,Y原子易失2个电子,根据电子得失相等可求化合物的化学式为YX2
4.利用元素质量比确定化学式:
例4:有一氮的氧化物,氮、氧两元素的质量比为7: 4,求此氧化物的化学式。
解析:设此氧化物的化学式为NxOy,根据xN:yO =7:4 得14x:16y=7:4,即x:y=2:1。
答案:所求氧化物的化学式为N2O。
5. 利用化学式中所含原子数、电子数确定化学式
例5:某氮氧化合物分子中含有3个原子,23个电子,求此化合物的化学式。
解析:设此化合物的化学式为NxOy,则
x+y=3
7x+8y=23
解得x=1,y=2
答案:所求化学式NO2。
利用化学式的变形比较元素的原子个数:
例:质量相等的SO2和SO3分子中,所含氧原子的个数比为?
解析:SO2的相对分子质量为64,SO3的相对分子质量为80,二者的最小公倍数是320,二者相对分子质量相等时物质的质量相同,转化为分子个数SO2 为320/64=5,SO3为320/80=4,即5SO2与4SO3质量相同,所以含氧原子的个数比为(5×2):(4×3)=10:12=5:6。
四、利用守恒法进行化学式计算:
例:由Na2S、Na2SO3、Na2SO4三种物质构成的混合物中,硫元素的质量分数为32%,则混合物中氧元素的质量分数为?
解析:在Na2S,Na2SO3,Na2SO4中,钠原子与硫原子的个数比是恒定的,都是2:1,因而混合物中钠、硫元素的质量比(或质量分数比)也是恒定的。设混合物中钠元素的质量分数为x,可建立如下关系式。
Na ——S
46 32
x 32%
46/32=x/32%
解得x=46%
混合物中氧元素的质量分数为1-32%-46%=22%。
利用平均值法判断混合物的组成
找出混合物中各组分的平均值(包括平均相对原子质量、平均相对分子质量、平均质量、平均质量分数等),再根据数学上的平均值原理,此平均值总是介于组成中对应值的最大值与最小值之间,由此对混合物的组分进行推理判断。
例:某气休可能由初中化学中常见的一种或多种气体组成,经测定其中只含C,O两种元素,其质量比为3:8,则该气体可能是?
解析:由题给条件知,该气体只含C,O两种元素,而这两种元素组成的气体可能是CO2、CO,O2。CO2中C,O两种元素的质量比是3:8,CO中C,O两种元素的质量比是3:4,O2中C,O两种元素的质量比是0 (因C的质量为0)。题中给出该气体中C,O两种元素的质量比是3:8,故符合题意的气体组成为:CO2或 CO,O2或CO,O2,CO2。
利用关系式法解题技巧:
关系式法是根据化学式所包含的各种比例关系,找出已知量之间的比例关系,直接列比例式进行计算的方法。
例: 多少克(NH4)2SO4与42.4g尿素CO(NH2)2所含的氮元素质量相等?
设与42.4g尿素中所含氮元素质量相等的(NH4)2SO4的质量为x
(NH4)2SO4——2N——CO(NH2)2
132 60
x 42.4g
132/x=60/42.4g
x=93.28
化学式前和化学式中数字的含义:
①化学式前面的数字表示粒子(原子、分子)数目;
②离子符号前的数字表示离子的数目;
③化学式石一下角的数字表示该粒子中对应原子或原子团的数目;
④离子符号右上角的数字表示该离子所带电荷数。

金属冶炼是把金属从化合态变为游离态的过程
矿石
①工业上能用来提炼金属的矿物叫做矿石。
②常见的矿石赤铁矿(Fe2O3)、黄铁矿(FeS2)、褐铁矿(Fe2O3·xH2O)、水铝石(Al2O3·H2O)、菱铁矿(主要成分是FeCO3)、磁铁矿(Fe3O4)、方铅矿(PbS)、孔雀石 [Cu2(OH)2CO3]、赤铜矿(Cu2O)、铝土矿(主要成分是Al2O3)、黄铜矿(主要成分是CuFeS2)、辉铜矿(主要成分是Cu2S)。
铁的冶炼
①原理:把铁矿石冶炼成铁是一个复杂的过程,其主要的反应原理是:
在高温下,利用还原剂一氧化碳把铁从铁矿石里还原出来,其反应的化学方程式是: Fe2O3+3CO
 2Fe+3CO2
2Fe+3CO2 ②炼铁的原料及作用:
铁矿石:提供原料
焦炭:提供能量,产生还原剂
石灰石:将矿石中的二氧化硅转变为炉渣。
③设备:高炉
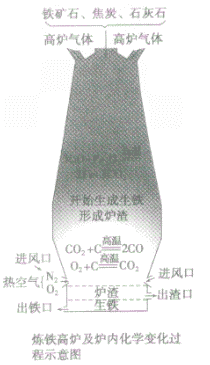
④高炉内有关反应:
a.产生CO提供能量:C+O2
 CO2;CO2+C
CO2;CO2+C 2CO
2COb.在高温下用CO将Fe从Fe2O3中还原出来:3CO+ Fe2O3
 2Fe + 3CO2
2Fe + 3CO2 c.用石灰石将矿石中的SiO2转变为炉渣除去。
CaCO3
 CaO+CO2↑,CaO+SiO2
CaO+CO2↑,CaO+SiO2 CaSiO3
CaSiO3⑤产品:生铁
炼铁高炉中出铁口低于出渣口的原因:
炼铁高炉中出铁口与出渣口的高低取决于铁水和炉渣的密度〔铁水的密度大于炉渣的密度)。
金属的冶炼方法:
①热分解法(适用于Hg,Ag不活泼的金属的冶炼,加热使其氧化物分解) 如:
2HgO=Hg+O2↑
②热还原法(适用于金属活动性顺序表中,Zn- Cu金属的冶炼)
a.用H2作还原剂(优点:制得金属纯度高,污染小) 如:Fe3O4+4H2
 3Fe+4H2O
3Fe+4H2O b.用焦炭、一氧化碳作还原剂(易混入杂质,污染大气,适合工业化大规模生产) 如:
炼铁的反应方程式为Fe2O3+3CO
 2Fe +3CO2
2Fe +3CO2炼锌的反应万程式为2ZnO+C
 2Zn+CO2↑
2Zn+CO2↑ c.用Al作还原剂(铝热剂用来焊接铁轨) 如:
8Al+3Fe3O4
 9Fe+4Al2O3
9Fe+4Al2O3 d.电解法(适用于活泼金属Na,Mg等的冶炼) 如:
2NaCl(熔融)
 2Na+Cl2↑ ;MgCl2(熔融)
2Na+Cl2↑ ;MgCl2(熔融) Mg+Cl2↑
Mg+Cl2↑ e.湿法冶金(从溶液中通过化学反应来获取金属) 如:
Fe+CuSO4==Cu+FeSO4
物质的相互转化和制备:
主要是指以氧气、氢气、碳、硫、磷等为代表的非金属单质,以铝、镁、锌、铁、铜为代表的金属单质,以一氧化碳、二氧化碳等为代表的非金属氧化物,以氧化铜、氧化铁等为代表的金属氧化物,以盐酸、硫酸、碳酸等为代表的酸,以氢氧化钠、氢氧化钙等为代表的碱,以氯化钠、碳酸钠、碳酸氢钠、碳酸钙等为代表的盐,等等物质之间的相互和制备.
物质的相互转化:
氢氧化钠与氢氧化钙的制备:
(1)NaOH的制备
方法一:Na2O+H2O==2NaOH
方法二:Na2CO3+Ca(OH)2==CaCO3↓ +2NaOH
(2)Ca(OH)2的制备方法:CaO+H2O==Ca(OH)2
常见物质的相互转化:
Na→Na2O→NaOH→Na2CO3
C→CO→CO2→H2CO3
Fe→Fe2O3→Fe2(SO4)3→Fe(OH)3→FeCl3
S→SO2→SO3→H2SO4(单质硫不能直接转化为SO3)
各类物质间的转化关系:
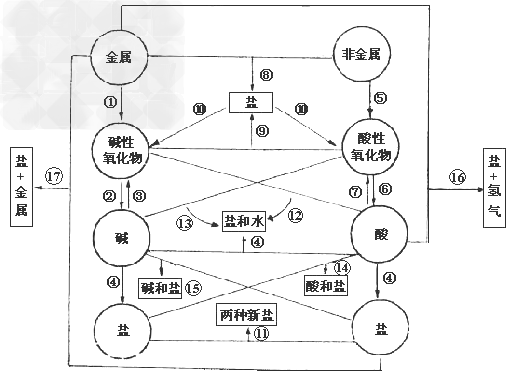
(1)金属+
 金属氧化物(碱性氧化物)
金属氧化物(碱性氧化物) 
(2)碱性氧化物(可溶)+水
 碱(可溶)
碱(可溶)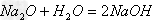
(3)碱(难溶)
 碱氧(难溶)+水
碱氧(难溶)+水 
(4)酸+碱
 盐+水
盐+水 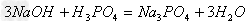 ;
;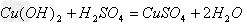
(5)非金属+
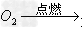 非金属氧化物(酸性氧化物)
非金属氧化物(酸性氧化物)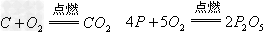
(6)酸性氧化物(易溶)+水
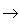 酸(易溶)
酸(易溶)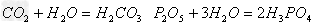
(7)酸(易挥发/难溶)
 酸氧+水(易挥发/难溶)
酸氧+水(易挥发/难溶) 
从纵向来看,金属
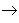 碱性氧化物
碱性氧化物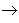 碱
碱 盐,其中金属元素相同。
盐,其中金属元素相同。非金属
 酸性氧化物
酸性氧化物 酸(含氧酸)
酸(含氧酸) 盐,其中非金属元素相同。
盐,其中非金属元素相同。横向:
(8)金属+非金属(无氧酸)
 盐
盐 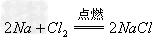
(9)碱氧+酸氧(含氧酸)
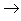 盐
盐
(10)含氧酸盐
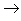 碱氧+酸氧
碱氧+酸氧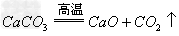
(11)盐+盐
 两种新盐
两种新盐 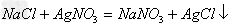
交叉:
(12)酸+碱氧
 盐+水
盐+水
(13)碱+酸氧
 盐+水
盐+水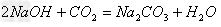
(14)酸+盐
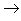 新酸+新盐
新酸+新盐 ;
;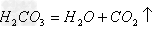
(15)碱+盐
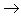 新碱+新盐
新碱+新盐
(16)金属+酸
 盐+
盐+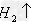
(17)金属+盐
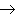 新盐+新金属
新盐+新金属(18)金属+盐
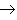 新盐+新金属
新盐+新金属 (置换反应)
(置换反应)与“类推的思维方法在化学学习与研究中经常用到,但有时会产生错...”考查相似的试题有:
- 下列关于使在空气中燃着的蜡烛熄灭的叙述正确的是( )A.只要使蜡烛隔绝空气B.必须把温度降至蜡烛的着火点以下C.必须使蜡...
- 下列各组化学式,其中书写全部正确的一组是( )A.Fe FeClB.CaOH Fe2(SO4)3C.K2CO3 Al(OH)3D.NH4Cl2 NH3
- 请从给定化合价的+1K、+2Cu、-2O、+5N、+1H五种元素中,选择适当的元素,按下列要求写出物质的化学式:(1)单质______;(2...
- 葡萄糖(C6H12O6)是一种有甜味、易溶于水的白色粉末状固体。请根据葡萄糖的化学式进行以下计算:(1)葡萄糖的相对分子质量...
- 地壳中含量最多的非金属和铁元素能形成哪几种化合物?写出化学式和名称. _________( );_____________( ); ___________( )。
- 下列物质的化学名称与俗名,对应关系不正确的是( )A.氢氧化钙--生石灰B.氢氧化钠--苛性钠C.碳酸钠--苏打D.碳酸氢钠--小...
- 车用乙醇汽油是将乙醇(C2H5OH)与汽油(以C8H18表示)按一定比例混合而成的一种汽车燃料。(1)乙醇分子中,组成元素的原子...
- 下列各组溶液,不加其它试剂就能鉴别的是A.NaOH、NaCl、CuSO4B.KCl、AgNO3、HClC.BaCl2、Na2CO3、HClD.CuSO4、NaCl、KNO3
- A~G均为初中常见的化学物质(“→”表示物质 间的转化关系,“—”表示两端的物质能发生化学反应),其中A、F是初中阶段常见的两种...
- 已知A—G为中学化学中常见物质,它们之间有如图所示的转化关系(部分生成物已略去),其中A、E、F为单质,A、E为固体,E为产量...