本试题 “环境问题是全球关注的问题.(1)酸雨会对环境造成危害.煤燃烧时会排放出CO2、CO、SO2、NO2等气体,其中能形成酸雨的是______.(2)2009年12月8日,在哥本...” 主要考查您对酸雨
质量守恒定律
化学反应方程式的书写
文字表达式
相对分子质量
物质组成元素的质量比
物质组成元素的质量分数
二氧化碳对环境的影响
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 酸雨
- 质量守恒定律
- 化学反应方程式的书写
- 文字表达式
- 相对分子质量
- 物质组成元素的质量比
- 物质组成元素的质量分数
- 二氧化碳对环境的影响
概念:
酸雨是指PH值小于5.6的雨雪或其他形式的降水。雨、雪等在形成和降落过程中,吸收并溶解了空气中的二氧化硫、氮氧化物等物质,形成了pH低于5.6的酸性降水。酸雨主要是人为的向大气中排放大量酸性物质造成的。我国的酸雨主要是因大量燃烧含硫量高的煤而形成的,多为硫酸雨,少为硝酸雨,此外,各种机动车排放的尾气也是形成酸雨的重要原因。
酸雨形成的化学反应过程:
(1)酸雨多成于化石燃料的燃烧:
含有硫的煤燃烧生成二氧化硫 S+O2 SO2
SO2
二氧化硫和水作用生成亚硫酸 SO2+H2O==H2SO3
亚硫酸在空气中可氧化成硫酸 2H2SO3+O2→2H2SO4
(2)氮氧化物溶于水形成酸:雷雨闪电时,大气中常有少量的二氧化氮产生。
闪电时氮气与氧气化合生成一氧化氮 N2+O2 2NO
2NO
一氧化氮结构上不稳定,空气中氧化成二氧化氮 2NO+O2=2NO2
二氧化氮和水作用生成硝酸 3NO2+H2O=2HNO3+NO
(3)酸雨与大理石反应:
CaCO3+H2SO4==CaSO4+H2O+CO2↑ CaSO3+SO2+H2O==Ca(HSO3)2
(4)此外还有其他酸性气体溶于水导致酸雨,例如氟化氢,氟气,氯气,硫化氢等其他酸性气体。
酸雨防治:
(1)开发新能源,如氢能,太阳能,水能,潮汐能,地热能等。
(2)使用燃煤脱硫技术,减少二氧化硫排放。
(3)工业生产排放气体处理后再排放。
(4)少开车,多乘坐公共交通工具出行。
(5)使用天然气等较清洁能源,少用煤。
酸雨是指PH值小于5.6的雨雪或其他形式的降水。雨、雪等在形成和降落过程中,吸收并溶解了空气中的二氧化硫、氮氧化物等物质,形成了pH低于5.6的酸性降水。酸雨主要是人为的向大气中排放大量酸性物质造成的。我国的酸雨主要是因大量燃烧含硫量高的煤而形成的,多为硫酸雨,少为硝酸雨,此外,各种机动车排放的尾气也是形成酸雨的重要原因。
酸雨形成的化学反应过程:
(1)酸雨多成于化石燃料的燃烧:
含有硫的煤燃烧生成二氧化硫 S+O2
 SO2
SO2 二氧化硫和水作用生成亚硫酸 SO2+H2O==H2SO3
亚硫酸在空气中可氧化成硫酸 2H2SO3+O2→2H2SO4
(2)氮氧化物溶于水形成酸:雷雨闪电时,大气中常有少量的二氧化氮产生。
闪电时氮气与氧气化合生成一氧化氮 N2+O2
 2NO
2NO 一氧化氮结构上不稳定,空气中氧化成二氧化氮 2NO+O2=2NO2
二氧化氮和水作用生成硝酸 3NO2+H2O=2HNO3+NO
(3)酸雨与大理石反应:
CaCO3+H2SO4==CaSO4+H2O+CO2↑ CaSO3+SO2+H2O==Ca(HSO3)2
(4)此外还有其他酸性气体溶于水导致酸雨,例如氟化氢,氟气,氯气,硫化氢等其他酸性气体。
酸雨防治:
(1)开发新能源,如氢能,太阳能,水能,潮汐能,地热能等。
(2)使用燃煤脱硫技术,减少二氧化硫排放。
(3)工业生产排放气体处理后再排放。
(4)少开车,多乘坐公共交通工具出行。
(5)使用天然气等较清洁能源,少用煤。
知识拓展:
1. 酸雨区
某地收集到酸雨样品,还不能算是酸雨区,因为一年可有数十场雨,某场雨可能是酸雨,某场雨可能不是酸雨,所以要看年均值。目前我国定义酸雨区的科学标准尚在讨论之中,但一般认为:年均降水pH高于5.65,酸雨率是0-20%,为非酸雨区;pH在5.30--5.60之间,酸雨率是10--40%,为轻酸雨区;pH在5.00--5.30之间,酸雨率是30-60%,为中度酸雨区;pH在4.70--5.00之间,酸雨率是50-80%,为较重酸雨区;pH小于4.70,酸雨率是70-100%,为重酸雨区。这就是所谓的五级标准。其实,北京、拉萨、西宁、兰州和乌鲁木齐等市也收集到几场酸雨,但年均pH和酸雨率都在非酸雨区标准内,故为非酸雨区。
2. 我国三大酸雨区
我国酸雨主要是硫酸型
我国三大酸雨区分别为:
(1)西南酸雨区:是仅次于华中酸雨区的降水污染严重区域。
(2)华中酸雨区:目前它已成为全国酸雨污染范围最大,中心强度最高的酸雨污染区。
(3)华东沿海酸雨区:它的污染强度低于华中、西南酸雨区。
质量守恒定律的概念及对概念的理解:
(1)概念:参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。这个规律就叫做质量守恒定律。
(2)对概念的理解:
①质量守恒定律只适用于化学反应,不能用于物理变化例如,将2g水加热变成2g水蒸气,这一变化前后质量虽然相等,但这是物理变化,不能说它遵守质量守恒定律。
②质量守恒定律指的是“质量守恒”,不包括其他方面的守恒,如对反应物和生成物均是气体的反应来说,反应前后的总质量守恒,但是其体积却不一定守恒。
③质量守恒定律中的第一个“质量”二字,是指“参加”化学反应的反应物的质量,不是所有反应物质量的任意简单相加。
例如,2g氢气与8g氧气在点燃的条件下,并非生成10g水,而是1g氢气与8g氧气参加反应,生成9g水
④很多化学反应中有气体或沉淀生成,因此“生成的各物质质量总和”包括了固态、液态和气态三种状态的物质,不能把生成的特别是逸散到空气中的气态物质计算在“总质量”之外而误认为化学反应不遵循质量守恒定律
质量守恒定律的微观实质:
(1)化学反应的实质在化学反应过程中,参加反应的各物质(反应物) 的原子,重新组合而生成其他物质(生成物)的过程。由分子构成的物质在化学反应中的变化过程可表示为:

(2)质量守恒的原因在化学反应中,反应前后原子的种类没有改变,数目没有增减,原子本身的质量也没有改变,所以,反应前后的质量总和必然相等。例如,水通电分解生成氢气和氧气,从微观角度看:当水分子分解时,生成氢原子和氧原子,每两个氢原子结合成一个氢分子,每两个氧原子结合成一个氧分子。
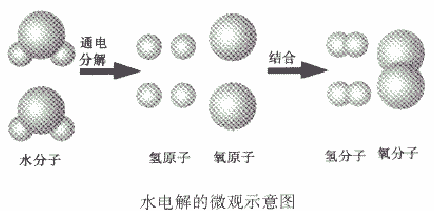
质量守恒定律的延伸和拓展理解:
质量守恒定律要抓住“六个不变”,“两个一定变”“两个可能变”。
如从水电解的微观示意图能得出的信息:
①在化学反应中,分子可以分成原子,原子又重新组合成新的分子;
②一个水分子是由两个氢原子和一个氧原子构成的,或一个氧分子由两个氧原子构成、一个氧分子由两个氢原子构成。或氢气、氧气是单质,水是化合物
③原子是化学变化中的最小粒子。
④水是由氢、氧两种元素组成的。
⑤在化学反应,氧元素的种类不变。
⑥在化学反应中,原子的种类、数目不变。
⑦参加反应的各物质的质量总和等于反应后生成的各物质的质量总和。
质量守恒定律的发现:
1. 早在300多年前,化学家们就对化学反应进行定量研究。1673年,英国化学家波义耳(RobertBoyle, 1627-1691)在一个敞口的容器中加热金属,结果发现反应后容器中物质的质量增加了。
2. 1756年,俄国化学家罗蒙诺索夫把锡放在密闭的容器里锻烧,锡发生变化,生成白色的氧化锡,但容器和容器里物质的总质量,在锻烧前后并没有发生变化。经过反复实验,都得到同样的结果,于是他认为在化学变化中物质的质量是守恒的。
3. 1774年,法国化学家拉瓦锡用精确的定量实验法,在密封容器中研究氧化汞的分解与合成中各物质质量之间的关系,得到的结论是:参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。
4. 后来.人们用先进的测址仪器做了大量精度极高的实验,确认拉瓦易的结论是正确的。从此,质量守恒定律被人们所认识。
质量守恒定律的应用:
(1)解释问题
①解释化学反应的本质—生成新物质,不能产生新元素(揭示伪科学的谎言问题)。
②解释化学反应前后物质的质量变化及用质量差确定某反应物或生成物。
(2)确定反应物或生成物的质量
确定反应物或生成物的质量时首先要遵循参加反应的各种物质的质量总量等于生成的各种物质的质量总和;其次各种物质的质量比等于相对分子质量与化学计量数的乘积之比。
(3)确定物质的元素组成
理解在化学反应前后,元素的种类不发生改变。可通过计算确定具体的元素质量。
(4)确定反应物或生成物的化学式
比较反应前后各种原子个数的多少,找出原子个数的差异。但不能忘记化学式前的化学计量数。
(5)确定某物质的相对分子质量(或相对原子质量)
运用质量守恒定律确定某物质的相对分子质量 (或相对原子质量)时,首先寻找两种已知质量的物质,再根据化学方程式中各物质间的质量成正比即可计算得出。注意观察物质化学式前面的化学计量数。
(6)确定化学反应的类型
判定反应的类型,首先根据质量守恒定律判断反应物、生成物的种类和质量(从数值上看,反应物质量减少,生成物质最增加)。如果是微观示意图,要对比观察减少的粒子和增加的粒子的种类和数目再进行判断。
(7)判断化学方程式是否正确
根据质量守恒定律判断化学方程式的对与否关键是看等号两边的原子总数是否相等,同时注意化学式书写是否有误。
(1)概念:参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。这个规律就叫做质量守恒定律。
(2)对概念的理解:
①质量守恒定律只适用于化学反应,不能用于物理变化例如,将2g水加热变成2g水蒸气,这一变化前后质量虽然相等,但这是物理变化,不能说它遵守质量守恒定律。
②质量守恒定律指的是“质量守恒”,不包括其他方面的守恒,如对反应物和生成物均是气体的反应来说,反应前后的总质量守恒,但是其体积却不一定守恒。
③质量守恒定律中的第一个“质量”二字,是指“参加”化学反应的反应物的质量,不是所有反应物质量的任意简单相加。
例如,2g氢气与8g氧气在点燃的条件下,并非生成10g水,而是1g氢气与8g氧气参加反应,生成9g水
④很多化学反应中有气体或沉淀生成,因此“生成的各物质质量总和”包括了固态、液态和气态三种状态的物质,不能把生成的特别是逸散到空气中的气态物质计算在“总质量”之外而误认为化学反应不遵循质量守恒定律
质量守恒定律的微观实质:
(1)化学反应的实质在化学反应过程中,参加反应的各物质(反应物) 的原子,重新组合而生成其他物质(生成物)的过程。由分子构成的物质在化学反应中的变化过程可表示为:

(2)质量守恒的原因在化学反应中,反应前后原子的种类没有改变,数目没有增减,原子本身的质量也没有改变,所以,反应前后的质量总和必然相等。例如,水通电分解生成氢气和氧气,从微观角度看:当水分子分解时,生成氢原子和氧原子,每两个氢原子结合成一个氢分子,每两个氧原子结合成一个氧分子。

质量守恒定律的延伸和拓展理解:
质量守恒定律要抓住“六个不变”,“两个一定变”“两个可能变”。
| 六个不变 | 宏观 | 反应前后的总质量不变 |
| 元素的种类不变 | ||
| 元素的质量不变 | ||
| 微观 | 原子的种类不变 | |
| 原子的数目不变 | ||
| 原子的质量不变 |
| 两个一定变 | 物质的种类一定变 |
| 构成物质的分子种类一定变 |
| 两个可能变 | 分子的总数可能变 |
| 元素的化合价可能变 |
如从水电解的微观示意图能得出的信息:
①在化学反应中,分子可以分成原子,原子又重新组合成新的分子;
②一个水分子是由两个氢原子和一个氧原子构成的,或一个氧分子由两个氧原子构成、一个氧分子由两个氢原子构成。或氢气、氧气是单质,水是化合物
③原子是化学变化中的最小粒子。
④水是由氢、氧两种元素组成的。
⑤在化学反应,氧元素的种类不变。
⑥在化学反应中,原子的种类、数目不变。
⑦参加反应的各物质的质量总和等于反应后生成的各物质的质量总和。
质量守恒定律的发现:
1. 早在300多年前,化学家们就对化学反应进行定量研究。1673年,英国化学家波义耳(RobertBoyle, 1627-1691)在一个敞口的容器中加热金属,结果发现反应后容器中物质的质量增加了。
2. 1756年,俄国化学家罗蒙诺索夫把锡放在密闭的容器里锻烧,锡发生变化,生成白色的氧化锡,但容器和容器里物质的总质量,在锻烧前后并没有发生变化。经过反复实验,都得到同样的结果,于是他认为在化学变化中物质的质量是守恒的。
3. 1774年,法国化学家拉瓦锡用精确的定量实验法,在密封容器中研究氧化汞的分解与合成中各物质质量之间的关系,得到的结论是:参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。
4. 后来.人们用先进的测址仪器做了大量精度极高的实验,确认拉瓦易的结论是正确的。从此,质量守恒定律被人们所认识。
质量守恒定律的应用:
(1)解释问题
①解释化学反应的本质—生成新物质,不能产生新元素(揭示伪科学的谎言问题)。
②解释化学反应前后物质的质量变化及用质量差确定某反应物或生成物。
(2)确定反应物或生成物的质量
确定反应物或生成物的质量时首先要遵循参加反应的各种物质的质量总量等于生成的各种物质的质量总和;其次各种物质的质量比等于相对分子质量与化学计量数的乘积之比。
(3)确定物质的元素组成
理解在化学反应前后,元素的种类不发生改变。可通过计算确定具体的元素质量。
(4)确定反应物或生成物的化学式
比较反应前后各种原子个数的多少,找出原子个数的差异。但不能忘记化学式前的化学计量数。
(5)确定某物质的相对分子质量(或相对原子质量)
运用质量守恒定律确定某物质的相对分子质量 (或相对原子质量)时,首先寻找两种已知质量的物质,再根据化学方程式中各物质间的质量成正比即可计算得出。注意观察物质化学式前面的化学计量数。
(6)确定化学反应的类型
判定反应的类型,首先根据质量守恒定律判断反应物、生成物的种类和质量(从数值上看,反应物质量减少,生成物质最增加)。如果是微观示意图,要对比观察减少的粒子和增加的粒子的种类和数目再进行判断。
(7)判断化学方程式是否正确
根据质量守恒定律判断化学方程式的对与否关键是看等号两边的原子总数是否相等,同时注意化学式书写是否有误。
化学方程式的书写原则遵循两个原则:
一是必须以客观事实为基础,绝不能凭空设想、主观臆造事实上不存在的物质和化学反应;
二是遵循质量守恒定律,即方程式两边各种原子的种类和数目必须相等。
书写化学方程式的具体步骤:
(1)写:根据实验事实写出反应物和生成物的化学式。反应物在左,生成物在右,中间用横线连接,如: H2+O2——H2O,H2O——H2+O2。
(2)配:根据反应前后原子的种类和数目不变的原则,在反应物和生成物的化学式前配上适当的化学计量数,使各种元素的原子个数在反应前后相等,然后将横线变成等号。配平后,化学式前的化学计量数之比应是最简整数比,如:2H2+O2=2H2O,2H2O= 2H2+O2。
(3)注:注明反应条件【如点燃、加热(常用“△”表示)、光照、通电等〕和生成物的状态(气体用“↑”。沉淀用“↓”。)。如:2H2+O2 2H2O,2H2O
2H2O,2H2O 2H2↑+O2↑。
2H2↑+O2↑。
化学计量数:
化学计量数指配平化学方程式后,化学式前面的数字。在化学方程式中,各化学式前的化学计量数之比应是最简整数比,计数量为1时,一般不写出。
书学化学方程式的常见错误:
书写化学方程式时条件和气体、沉淀符号的使用:
(1).“△”的使用
①“△”是表示加热的符号,它所表示的温度一般泛指用酒精灯加热的温度。
②如果一个反应在酒精灯加热的条件下能发生,书写化学方程式时就用“△”,如:2KMnO4 K2MnO4+MnO2+O2↑。
K2MnO4+MnO2+O2↑。
③如果一个反应需要的温度高于用酒精灯加热的温度,一般用“高温”表示;如:CaCO3 CaO+ CO2↑
CaO+ CO2↑
(2)“↑”的使用
①“↑”表示生成物是气态,只能出现在等号的右边。
②当反应物为固体、液体,且生成的气体能从反应体系中逸出来,气体化学式后应该加“↑”。如Fe+ 2HCl==FeCl2+H2↑。
③当反应物是溶液时,生成的气体容易溶于水而不能从反应体系中逸出来,则不用“↑”,如:H2SO4+ BaCl2==FeCl2+2HCl
④只有生成物在该反应的温度下为气态,才能使用“↑”。
⑤若反应物中有气态物质,则生成的气体不用标 “↑”。如:C+O2 CO2
CO2
(3)“↓”使用
①“↓”表示难溶性固体生成物,只能出现在等号的右边
②当反应在溶液中进行,有沉淀生成时,用 “↓”,如:AgNO3+HCl==AgCl↓+HNO3
③当反应不在溶液中进行,尽管生成物有不溶性固体,也不用标“↓”,如:2Cu+O2 2CuO
2CuO
④反应在溶液中进行,若反应物中有难溶性物质,生成物中的难溶性物质后面也不用标“↓”。如:Fe +CuSO4==FeSO4+Cu.
化学方程式中“↑”和“↓”的应用:
①“↑”或“↓”是生成物状态符号,无论反应物是气体还是固体,都不能标“↑”或“↓”;
②若反应在溶液中进行且生成物中有沉淀,则使用“↓”;若不在溶液中进行,无论生成物中是否有固体或难溶物,都不使用“↓”;
③常温下,若反应物中无气体,生成物中有气体.
提取信息书写化学方程式的方法:
书写信息型化学方程式是中考热点,题目涉及社会、生产、生活、科技等各个领域,充分体现了化学学科的重要性,并考查了同学们接受信息、分析问题和解决问题的能力。解答这类题日的关键是掌握好化学方程式的书写步骤,可按两步进行:首先正确书写反应物和生成物的化学式,并注明反应条件及生成物状态;第二步就是化学方程式的配平。
一是必须以客观事实为基础,绝不能凭空设想、主观臆造事实上不存在的物质和化学反应;
二是遵循质量守恒定律,即方程式两边各种原子的种类和数目必须相等。
书写化学方程式的具体步骤:
(1)写:根据实验事实写出反应物和生成物的化学式。反应物在左,生成物在右,中间用横线连接,如: H2+O2——H2O,H2O——H2+O2。
(2)配:根据反应前后原子的种类和数目不变的原则,在反应物和生成物的化学式前配上适当的化学计量数,使各种元素的原子个数在反应前后相等,然后将横线变成等号。配平后,化学式前的化学计量数之比应是最简整数比,如:2H2+O2=2H2O,2H2O= 2H2+O2。
(3)注:注明反应条件【如点燃、加热(常用“△”表示)、光照、通电等〕和生成物的状态(气体用“↑”。沉淀用“↓”。)。如:2H2+O2
 2H2O,2H2O
2H2O,2H2O 2H2↑+O2↑。
2H2↑+O2↑。 化学计量数:
化学计量数指配平化学方程式后,化学式前面的数字。在化学方程式中,各化学式前的化学计量数之比应是最简整数比,计数量为1时,一般不写出。
书学化学方程式的常见错误:
| 常见错误 | 违背规律 |
| 写错物质的化学式 | 客观事实 |
| 臆造生成物或事实上不存在的化学反应 | |
| 写错或漏泄反应条件 | |
| 化学方程式没有配平 | 质量守恒 |
| 漏标多标“↑”、“↓”符号 | —— |
书写化学方程式时条件和气体、沉淀符号的使用:
(1).“△”的使用
①“△”是表示加热的符号,它所表示的温度一般泛指用酒精灯加热的温度。
②如果一个反应在酒精灯加热的条件下能发生,书写化学方程式时就用“△”,如:2KMnO4
 K2MnO4+MnO2+O2↑。
K2MnO4+MnO2+O2↑。 ③如果一个反应需要的温度高于用酒精灯加热的温度,一般用“高温”表示;如:CaCO3
 CaO+ CO2↑
CaO+ CO2↑(2)“↑”的使用
①“↑”表示生成物是气态,只能出现在等号的右边。
②当反应物为固体、液体,且生成的气体能从反应体系中逸出来,气体化学式后应该加“↑”。如Fe+ 2HCl==FeCl2+H2↑。
③当反应物是溶液时,生成的气体容易溶于水而不能从反应体系中逸出来,则不用“↑”,如:H2SO4+ BaCl2==FeCl2+2HCl
④只有生成物在该反应的温度下为气态,才能使用“↑”。
⑤若反应物中有气态物质,则生成的气体不用标 “↑”。如:C+O2
 CO2
CO2 (3)“↓”使用
①“↓”表示难溶性固体生成物,只能出现在等号的右边
②当反应在溶液中进行,有沉淀生成时,用 “↓”,如:AgNO3+HCl==AgCl↓+HNO3
③当反应不在溶液中进行,尽管生成物有不溶性固体,也不用标“↓”,如:2Cu+O2
 2CuO
2CuO ④反应在溶液中进行,若反应物中有难溶性物质,生成物中的难溶性物质后面也不用标“↓”。如:Fe +CuSO4==FeSO4+Cu.
化学方程式中“↑”和“↓”的应用:
①“↑”或“↓”是生成物状态符号,无论反应物是气体还是固体,都不能标“↑”或“↓”;
②若反应在溶液中进行且生成物中有沉淀,则使用“↓”;若不在溶液中进行,无论生成物中是否有固体或难溶物,都不使用“↓”;
③常温下,若反应物中无气体,生成物中有气体.
提取信息书写化学方程式的方法:
书写信息型化学方程式是中考热点,题目涉及社会、生产、生活、科技等各个领域,充分体现了化学学科的重要性,并考查了同学们接受信息、分析问题和解决问题的能力。解答这类题日的关键是掌握好化学方程式的书写步骤,可按两步进行:首先正确书写反应物和生成物的化学式,并注明反应条件及生成物状态;第二步就是化学方程式的配平。
概念:用文字表示化学反应的式子
文字表达式的书写步骤:
(1)写:根据反应事实写出反应物和生成物
(2)注:注明反应条件:[点燃,加热,光照,通电等]
文字表达式的书写步骤:
(1)写:根据反应事实写出反应物和生成物
(2)注:注明反应条件:[点燃,加热,光照,通电等]
定义:
相对分子质量就是化学式中各原子的相对原子质量的总和,符号为Mr。如化学式为AmBn的物质的相对分子质量Mr=A的相对原子质量×m+B的相对原子质量×n。
易错易混点:
①化学式中原子团右下角的数字表示其个数(但BaSO4中的4表示氧原子的个数.不表示原子团 SO42-的个数),计算时先求一个原子团的相对质量,再乘以其个数。如Ca(OH)2的相对分子质量=40+(1+16)× 2=74;
②化学式中的圆点,如“CuSO4·5H2O”中的“·” 表示和,不表示积。即CuSO4·5H2O的相对分子质量CuSO4的相对分子质量+H2O的相对分子量×5=160+18×5=250;
③相对分子质量的单位为1,书写时省略不写;
④计算多个相同分子的相对分子质量总和时,应先求出化学式的相对分子质量再乘以前面的系数,如2KClO,的相对分子质量=2×(39+35.5+16×3) =245;
⑤若已知化合物中某原子的相对原子质量A和原了个数n及其质量分数x%,则化合物的相对分子质量=
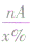
定义:
化合物里各元素的质量比是原子个数与相对原子质量的乘积之比。即各元素原子的相对原子质量总和之比。计算的关键在于正确判断出各元素的原子总数。
公式:
各元素的质量比=各元素相对原子质量与相应原子个数的乘积之比。如化学式为AmBn的物质中,A、B两元素的质量比 =(A的相对原子质量×m):(B的相对原子质量×n)。
对概念公式的理解:
(1)元素是宏观概念,只讲种类,不讲个数。用元素符号表示时,7C素符号前后都不能写数字,如计算四氧化三铁(Fe3O4)中铁元素和氧元素的质量比时不能写成3Fe:4O
(2)在化学式中,原子个数比等于元素的质量除以其相对原子质量之比。如AmBn中A,B两元素的质量比为M:N,则化学式中A,B两元素的原子个数比m:n=
(3)当化学式中含有多种元素时,根据化学式可以计算出全部元素的质量比,也可以计算出其中某几种元素的质量比。
化学式中元素质量比的变式运算:
在AmBn中元素A,B的质量比等于各元素的相对原子质m与原子个数的乘积比,即A,B元素质量比= (A的相对原子质量×m):(B的相对原子质量×n),根据元素质量比的变形运算主要有:
(1)根据某化合物中元素的质最比求化学式根据化合物中元素的质量比(或元素的质量分数比)求化学式,其方法是通过元素的相对原子质量来推断化学式。通过组成元素质量比或元素的质量分数进行分式变换,转换成原子个数(比),推测化学式。
(2)根据某化合物中元素的质量比确定元素的化合价已知某化合物中元素的质量比确定某元素的化合价,可通过元素的质量比及元素的相对原子质量推断化学式中元素的原子个数之比,再根据化合物中正负化合价代数和为零的原则确定元素的化合价。
(3)根据元素的质量比确定元素的相对原子质量
化合物中元素的质量比等于相对原子质量与原子个数的乘积比,利用元素的质量比及化合物中各原子的个数即可求出元素的相对原子质量。相对原子质量之比等于元素的质量除以其原子个数所得的数值之比。
(4)物质的质量比与分子个数比之间的换算:
换算关系:物质的质量比 分子个数比、如SO3、SO2、O2三种物质的质量比为5:4:2,则SO3、SO2、O2的分子个数比为
分子个数比、如SO3、SO2、O2三种物质的质量比为5:4:2,则SO3、SO2、O2的分子个数比为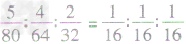 =1:1:1
=1:1:1
利用化学式变形求物质的质量比:
例:含有相同质量铁元素的Fe2O3和Fe3O4的质量比是多少?
解析:设含有相同质量铁元素的Fe2O3和Fe3O4的质量分别为x,y,为了使两者含铁元素的质量相等,可以将它们的化学式变形为铁原子数目相等的式子:
Fe2O3→Fe6O9 Fe3O4→Fe6O8
480 464
x y
x:y=480:464=30:29
答案:30:29
化合物里各元素的质量比是原子个数与相对原子质量的乘积之比。即各元素原子的相对原子质量总和之比。计算的关键在于正确判断出各元素的原子总数。
公式:
各元素的质量比=各元素相对原子质量与相应原子个数的乘积之比。如化学式为AmBn的物质中,A、B两元素的质量比 =(A的相对原子质量×m):(B的相对原子质量×n)。
对概念公式的理解:
(1)元素是宏观概念,只讲种类,不讲个数。用元素符号表示时,7C素符号前后都不能写数字,如计算四氧化三铁(Fe3O4)中铁元素和氧元素的质量比时不能写成3Fe:4O
(2)在化学式中,原子个数比等于元素的质量除以其相对原子质量之比。如AmBn中A,B两元素的质量比为M:N,则化学式中A,B两元素的原子个数比m:n=

(3)当化学式中含有多种元素时,根据化学式可以计算出全部元素的质量比,也可以计算出其中某几种元素的质量比。
化学式中元素质量比的变式运算:
在AmBn中元素A,B的质量比等于各元素的相对原子质m与原子个数的乘积比,即A,B元素质量比= (A的相对原子质量×m):(B的相对原子质量×n),根据元素质量比的变形运算主要有:
(1)根据某化合物中元素的质最比求化学式根据化合物中元素的质量比(或元素的质量分数比)求化学式,其方法是通过元素的相对原子质量来推断化学式。通过组成元素质量比或元素的质量分数进行分式变换,转换成原子个数(比),推测化学式。
(2)根据某化合物中元素的质量比确定元素的化合价已知某化合物中元素的质量比确定某元素的化合价,可通过元素的质量比及元素的相对原子质量推断化学式中元素的原子个数之比,再根据化合物中正负化合价代数和为零的原则确定元素的化合价。
(3)根据元素的质量比确定元素的相对原子质量
化合物中元素的质量比等于相对原子质量与原子个数的乘积比,利用元素的质量比及化合物中各原子的个数即可求出元素的相对原子质量。相对原子质量之比等于元素的质量除以其原子个数所得的数值之比。
(4)物质的质量比与分子个数比之间的换算:
换算关系:物质的质量比
 分子个数比、如SO3、SO2、O2三种物质的质量比为5:4:2,则SO3、SO2、O2的分子个数比为
分子个数比、如SO3、SO2、O2三种物质的质量比为5:4:2,则SO3、SO2、O2的分子个数比为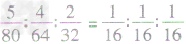 =1:1:1
=1:1:1利用化学式变形求物质的质量比:
例:含有相同质量铁元素的Fe2O3和Fe3O4的质量比是多少?
解析:设含有相同质量铁元素的Fe2O3和Fe3O4的质量分别为x,y,为了使两者含铁元素的质量相等,可以将它们的化学式变形为铁原子数目相等的式子:
Fe2O3→Fe6O9 Fe3O4→Fe6O8
480 464
x y
x:y=480:464=30:29
答案:30:29
定义:
物质中某元素的质量分数,就是该元素的质量与组成物质的各元素总质量之比。
公式:
某元素的质量分数=
如AmBn中A元素的质量分数=
若题目给出物质的化学式,又同时知道物质的实际质量,则可根据物质的质量×某元素的质量分数=该元素的质量,将其中所含元素的质量求出。同理,物质的质量=某元素质量÷该元素的质量分数。
公式的理解:
计算时应先列式计算,然后代入数据算出结果。如水中氢元素的质量分数=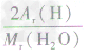 ×100%=
×100%= ×100%=
×100%= ×100%=11.1%而不能写成
×100%=11.1%而不能写成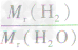 ×100%=
×100%= ×100%=
×100%= ×100%=11.1%
×100%=11.1%
化学式中质量分数的应用:
①已知物质的质量求所含的某元素的质量
利用公式:元素的质量=物质的质量×该元素的质量分数
②已知元素的质量求物质的质量
利用公式:物质的质量=元素的质量÷该元素的质量分数
③根据元素的质量分数确定物质的化学式
利用化学式的变形比较元素质量分数的大小:
例: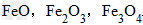 三种铁的氧化物按铁元素的质量分数由大到小排列的顺序为?
三种铁的氧化物按铁元素的质量分数由大到小排列的顺序为?
解析:三种含铁的氧化物的化学式可变形为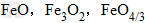 ,则三种含铁的氧化物中铁元素的质量分数分别为:
,则三种含铁的氧化物中铁元素的质量分数分别为: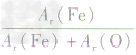 、
、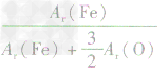 、
、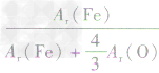 ,通过比较分母可知:
,通过比较分母可知: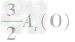 >
>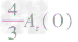 >Ar(O),故铁元素的质量分数由大到小排列的顺序为
>Ar(O),故铁元素的质量分数由大到小排列的顺序为 。
。
物质中某元素的质量分数,就是该元素的质量与组成物质的各元素总质量之比。
公式:
某元素的质量分数=

如AmBn中A元素的质量分数=

若题目给出物质的化学式,又同时知道物质的实际质量,则可根据物质的质量×某元素的质量分数=该元素的质量,将其中所含元素的质量求出。同理,物质的质量=某元素质量÷该元素的质量分数。
公式的理解:
计算时应先列式计算,然后代入数据算出结果。如水中氢元素的质量分数=
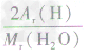 ×100%=
×100%= ×100%=
×100%= ×100%=11.1%而不能写成
×100%=11.1%而不能写成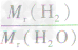 ×100%=
×100%= ×100%=
×100%= ×100%=11.1%
×100%=11.1%化学式中质量分数的应用:
①已知物质的质量求所含的某元素的质量
利用公式:元素的质量=物质的质量×该元素的质量分数
②已知元素的质量求物质的质量
利用公式:物质的质量=元素的质量÷该元素的质量分数
③根据元素的质量分数确定物质的化学式
利用化学式的变形比较元素质量分数的大小:
例:
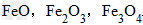 三种铁的氧化物按铁元素的质量分数由大到小排列的顺序为?
三种铁的氧化物按铁元素的质量分数由大到小排列的顺序为?解析:三种含铁的氧化物的化学式可变形为
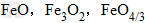 ,则三种含铁的氧化物中铁元素的质量分数分别为:
,则三种含铁的氧化物中铁元素的质量分数分别为: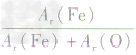 、
、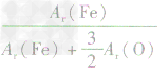 、
、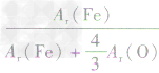 ,通过比较分母可知:
,通过比较分母可知: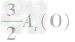 >
>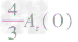 >Ar(O),故铁元素的质量分数由大到小排列的顺序为
>Ar(O),故铁元素的质量分数由大到小排列的顺序为 。
。对环境的影响:
主要是温室效应。因为二氧化碳具有保温的作用,会逐渐使地球表面温度升高。近100年,全球气温升高0.6℃,照这样下去,预计到21世纪中叶,全球气温将升高1.5——4.5℃。由温室效应所引起的海平面升高,也会对人类的生存环境产生巨大的影响。两极海洋的冰块也将全部融化。所有这些变化对野生动物而言无异于灭顶之灾。
大家要共同爱护环境,保护人类赖以生存的地球母亲。
CO2的产生:
⑴凡是有机物(包括动植物)在分解、发酵、腐烂、变质的过程中都可释放出CO?。
⑵石油、石腊、煤炭、天然气燃烧过程中,也要释放出CO?。
⑶石油、煤炭在生产化工产品过程中,也会释放出CO?。
⑷所有粪便、腐植酸在发酵,熟化的过程中也能释放出CO?。
⑸所有动物在呼吸过程中,都要吸氧气吐出CO?。
⑹所有绿色植物都吸收CO?释放出氧气,进行光合作用。CO?气体,就是这样,在自然生态平衡中,进行无声无息的循环。
⑺一切工业生产,城市运转,交通等都离不开排放二氧化碳。
危害:
现在地球上气温越来越高,是因为二氧化碳增多造成的。因为二氧化碳具有保温的作用,现在这一群体的成员越来越多,使温度升高,近100年,全球气温升高0.6℃,照这样下去,预计到2 二氧化碳的危害二氧化碳的危害(7张)1世纪中叶,全球气温将升高1.5——4.5℃。海平面升高,也是二氧化碳增多造成的,近100年,海平面上升14厘米,到21世纪中叶,海平面将会上升25——140厘米,海平面的上升,亚马逊雨林将会消失,两极海洋的冰块也将大部分融化。所有这些变化对野生动植物而言无异于灭顶之灾。 空气中一般含有约0.03%二氧化碳,但由于人类活动(如化石燃料燃烧)影响,近年来二氧化碳含量猛增,导致温室效应、全球气候变暖、冰川融化、海平面升高……旨在遏制二氧化碳过量排放的《京都议定书》已经生效,有望通过国际合作遏制温室效应。
二氧化碳的浓度达到1%以上,就会使人头晕目眩。达到4~5%,人便会恶心呕吐,呼吸不畅。超过10%,人便会死亡。
主要是温室效应。因为二氧化碳具有保温的作用,会逐渐使地球表面温度升高。近100年,全球气温升高0.6℃,照这样下去,预计到21世纪中叶,全球气温将升高1.5——4.5℃。由温室效应所引起的海平面升高,也会对人类的生存环境产生巨大的影响。两极海洋的冰块也将全部融化。所有这些变化对野生动物而言无异于灭顶之灾。
大家要共同爱护环境,保护人类赖以生存的地球母亲。
CO2的产生:
⑴凡是有机物(包括动植物)在分解、发酵、腐烂、变质的过程中都可释放出CO?。
⑵石油、石腊、煤炭、天然气燃烧过程中,也要释放出CO?。
⑶石油、煤炭在生产化工产品过程中,也会释放出CO?。
⑷所有粪便、腐植酸在发酵,熟化的过程中也能释放出CO?。
⑸所有动物在呼吸过程中,都要吸氧气吐出CO?。
⑹所有绿色植物都吸收CO?释放出氧气,进行光合作用。CO?气体,就是这样,在自然生态平衡中,进行无声无息的循环。
⑺一切工业生产,城市运转,交通等都离不开排放二氧化碳。
危害:
现在地球上气温越来越高,是因为二氧化碳增多造成的。因为二氧化碳具有保温的作用,现在这一群体的成员越来越多,使温度升高,近100年,全球气温升高0.6℃,照这样下去,预计到2 二氧化碳的危害二氧化碳的危害(7张)1世纪中叶,全球气温将升高1.5——4.5℃。海平面升高,也是二氧化碳增多造成的,近100年,海平面上升14厘米,到21世纪中叶,海平面将会上升25——140厘米,海平面的上升,亚马逊雨林将会消失,两极海洋的冰块也将大部分融化。所有这些变化对野生动植物而言无异于灭顶之灾。 空气中一般含有约0.03%二氧化碳,但由于人类活动(如化石燃料燃烧)影响,近年来二氧化碳含量猛增,导致温室效应、全球气候变暖、冰川融化、海平面升高……旨在遏制二氧化碳过量排放的《京都议定书》已经生效,有望通过国际合作遏制温室效应。
二氧化碳的浓度达到1%以上,就会使人头晕目眩。达到4~5%,人便会恶心呕吐,呼吸不畅。超过10%,人便会死亡。
发现相似题
与“环境问题是全球关注的问题.(1)酸雨会对环境造成危害.煤燃...”考查相似的试题有:
- 在实验室中,过氧化氢、高锰酸钾、氯酸钾均可用于制取氧气,主要原因是它们( )A.都含有氧元素B.都含有氧气C.都能发生分...
- 阅读下列材料并回答问题:一份最新联合国报告显示,人类的工业生产、交通运输等活动排放了大量的二氧化碳,同时人类的农牧业...
- 写出下列反应的化学方程式:(1)实验室用氯酸钾和二氧化锰混合制氧气 ;(2)电解水 ;(3)碳酸钠与稀盐酸反应 ;(4)二氧化碳通入...
- 小文一家三口到火锅店吃火锅。(1)火锅常用的燃料有木炭、天然气和酒精(固体酒精)等。天然气中的主要成分在空气中燃烧的化学...
- (5分)下表是元素周期表中部分元素的原子结构示意图,请分析:ⅠAⅡAⅢA第2周期第3周期X第4周期Y ⑴在化学反应中Mg原子易 (填“...
- 现有Ca、Na、C、O、S、H六种元素,请按照要求选用其中适宜的元素,用化学用语填空:(1)治疗胃酸过多症的物质 ;(2)写出一...
- 向5%的过氧化氢溶液中加入少量的Fe2O3后,能产生大量的氧气,且反应前后Fe2O3的质量和化学性质都没有改变,则反应中Fe2O3的作...
- 维生素C(化学式C6H806)能促进人体生长发育,增强人体对疾病的抵抗力.求(1)维生素C的相对分子质量______;(2)维生素C中...
- 阅读材料,回答问题.材料Ⅰ氯元素(Cl)是一种重要的非金属元素,氯气(Cl2)是双原子分子,在通常情况下为黄绿色有毒气体材...
- 血液中有一种含铜的呈蓝色的蛋白分子,其相对分子质量为151000。已知其中铜元素的质量分数为0.34%,则平均每个分子中含铜原子...