本试题 “金属材料是我们使用最广泛的一种材料,从古代到现代,金属材料经历了几次较大的变革。请回答下列问题。(1)下面表格中铁和铜的某些物理性质摘自某化学手册。由...” 主要考查您对氧化还原反应的配平
生活中的其他材料及应用(纳米材料、功能高分子材料等)
金属的冶炼
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 氧化还原反应的配平
- 生活中的其他材料及应用(纳米材料、功能高分子材料等)
- 金属的冶炼
配平简介:
化学反应方程式严格遵守质量守恒定律,书写化学反应方程式写出反应物和生成物后,往往左右两边各原子数目不相等,不满足质量守恒定律,这就需要通过配平来解决。
配平原则:
(1)电子守恒原则:反应中还原剂失去电子的总数与氧化剂得到电子的总数相等
(2)电荷守恒原则:若为离子反应,反应前后离子所带正负电荷总数相等
(3)质量守恒原则:反应前后各元素的原子个数相等
配平步骤:
(1)一标:标明反应前后化合价有变化的元素的化合价
(2)二等:通过求最小公倍数使化合价升降总值相等
(3)三定:确定氧化剂与还原剂的化学计量数
氧化剂(还原剂)化学计量数=降(升)价的最小公倍数÷1mol氧化剂(还原剂)降(升)价总数
(4)四平:用观察法配平其他物质的化学计量数
(5)五查:检查质量与电荷、电子是否分别守恒
配平技巧:
(1)逆向配平法:部分氧化还原反应、自身氧化还原反应等可用逆向配平法,即选择氧化产物、还原产物为基准物来配平(一般从反应物很难配平时,可选用逆向配平法)
例:
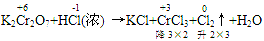
通过表明氧化产物、还原产物化合价的升降,确定CrCl3、Cl2的计量数为2和3,然后再用观察法配平。
(2)设“1”配平法:设某一反应物或生成物(一般选用组成元素较多的物质作基准物)的化学计量数为1,其余各物质的化学计量数可根据原子守恒原理列方程求得。
例:P4O+Cl2→POCl3+P2Cl6
可令P4O前的系数为1,Cl2的系数为x,则
1P4O+xCl2→POCl3+3/2P2Cl6 ,再由Cl原子守恒得2x=3+3/2×6 得x=6 即可配平
(3)零价配平法:先令无法用常规方法确定化合价的物质中各元素均为零价,然后计算出各元素化合价的升降值,并使元素化合价升降总数相等,最后用观察法配平其他物质的化学计量数。
例:Fe3C+HNO3=Fe(NO3)3+CO2↑+NO2↑+H2O
复杂化合物Fe3C按照常规方法分析,无法确定其Fe和C的具体化合价,此时可令组成物质的各元素化合价为零价,根据化合价升降法配平。
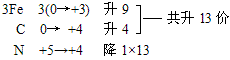
再用观察法确定物质的化学计量数。
(4)整体标价法:当某元素的原子在某化合物中有数个时,可将它作为一个整体对待,根据化合物中元素化合价代数和为零原则予以整体标价。
例:S+Ca(OH)2→CaSx+Ca2S2O3+H2O
生成物CaSx、Ca2S2O3中的Sx、S2作为一个整体标价为-2、+4价,则化合价升降关系为:
Sx 0→-2 降2×2
S2 0→+4 升4×1
即可配平。
(5)缺项配平法:一般先确定氧化剂、还原剂、氧化产物、还原产物的化学计量系数,再通过比较反应物与生成物,确定缺项(一般为H2O、H+或OH-),最后观察配平。
(6)有机氧化还原反应的配平:有机物中元素的化合价一般来讲,氢元素显+1价,氧元素显-2价,然后再根据化合价的代数和为零求酸碳元素的平均化合价。
氧化还原反应方程式配平的一般方法与步骤:
- 一般方法:从左向右配。
- 步骤:标变价,找变化,求总数,配系数。
- 标出元素化合价变化的始态和终态
- 求升价元素或降价元素化合价的变化数
- 求化合价变化数的最小公倍数,分别作为氧化剂或还原剂的系数
- 配平变价元素
- 用观察法配平其他元素
- 检查配平后的方程式是否符合质量守恒定律(离子方程式还要看电荷是否守恒)
如: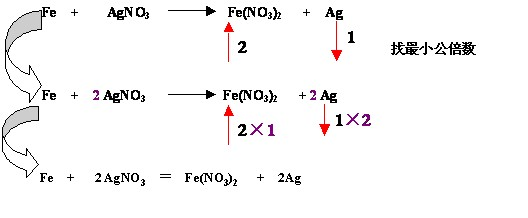
特殊技巧:
配平时若同一物质内既有元素的化合价上升又有元素的化合价下降,若从左向右配平较困难,可以采用从右向左配平,成为逆向配平法。
纳米材料:
材料的基本结构单元至少有一维处于纳米尺度范围(一般在1~100nm),并由此具有某些新特性的材料。
功能高分子材料:
一般指具有传递、转换或贮存物质、能量和信息作用的高分子及其复合材料,或具体地指在原有力学性能的基础上,还具有化学反应活性、光敏性、导电性、催化性、生物相容性、药理性、选择分离性、能量转换性、磁性等功能的高分子及其复合材料。
分类:
(1)化学功能:离子交换树脂、螯合树脂、感光性树脂、氧化还原树脂、高分子试剂、高分子催化剂、高分子增感剂、分解性高分子等
(2)物理功能:导电性高分子(包括电子型导电高分子、高分子固态离子导体、高分子半导体)、高介电性高分子(包括高分子驻极体、高分子压电体)、高分子光电导体、高分子光生伏打材料、高分子显示材料、高分子光致变色材料等
(3)复合功能:高分子吸附剂、高分子絮凝剂、高分子表面活性剂、高分子染料、高分子稳定剂、高分子相溶剂、高分子功能膜和高分子功能电极等
(4)生物、医用功能:抗血栓、控制药物释放和生物活性等
(1)把金属从化合态变为游离态。常用冶炼法:用碳一氧化碳氢气等还原剂与金属氧化物在高温下反应。
(2)冶炼的原理
①还原法:金属氧化物(与还原剂共热)--→游离态金属
②置换法:金属盐溶液(加入活泼金属)--→游离态金属
③火法冶炼(Pyrometallurgy)又称为干式冶金,把矿石和必要的添加物一起在炉中加热至高温,熔化为液体,生成所需的化学反应,从而分离出粗金属,然后再将粗金属精炼。
④湿式冶金(Hydrometallurgy) 湿法冶金这种冶金过程是用酸、碱、盐类的水溶液,以化学方法从矿石中提取所需金属组分,然后用水溶液电解等各种方法制取金属。此法主要应用在低本位、难熔化或微粉状的矿石。现在世界上有75%的锌和镉是采用焙烧-浸取-水溶液电解法制成的。这种方法已大部分代替了过去的火法炼锌。其他难于分离的金属如镍-钴,锆-铪,钽-铌及稀土金属都采用湿法冶金的技术如溶剂萃取或离子交换等新方法进行分离,取得显著的效果。
(3)常见金属冶炼:
①汞:热分解法:2HgO
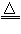 2Hg+O2(气体)
2Hg+O2(气体) ②铜:置换法:CuSO4+Fe==Cu+FeSO4(又叫湿法炼铜)
③铝:电解法:2Al2O3
 4Al+3O2(注意不能用AlCl3,因为AlCl3不是离子化合物)
4Al+3O2(注意不能用AlCl3,因为AlCl3不是离子化合物)④镁:电解法:MgCl2(l)
 Mg(s)+Cl2(g)↑
Mg(s)+Cl2(g)↑ ⑤钠:电解法:2NaCl
 2Na+Cl2↑
2Na+Cl2↑ ⑥钾:原理是高沸点金属制低沸点金属:Na+KCl==K+NaCl(反应条件是高温,真空。)
⑦铁:热还原法:2Fe2O3+3C
 2Fe+3CO2↑
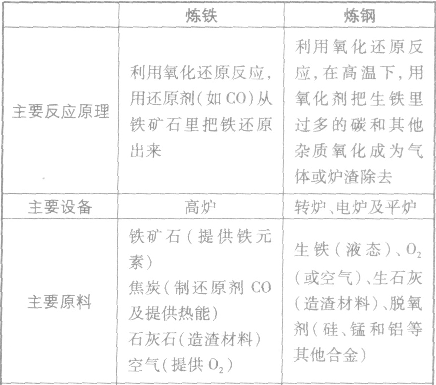
2Fe+3CO2↑ 炼铁和炼钢的比较:

铝的冶炼:
(1)由铝土矿制氧化铝
①将铝土矿中的氧化铝水合物溶解在氢氧化钠溶液中: 
②向偏铝酸钠溶液中通入二氧化碳,析出氢氧化铝: 
③使氢氧化铝脱水生成氧化铝:
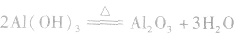
(2)电解氧化铝制备铝
电解时,以氧化铝、冰晶石(Na2AlF6)熔融液为电解质,其中也常加入少量的氟化钙等帮助降低熔点;阳极和阴极以碳素材料做成,在电解槽的钢板和阴极碳素材料之间还要放置耐火绝缘材料。
①主要设备——电解槽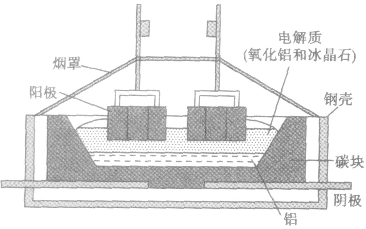
②电极反应式
阳极反应: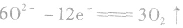
阴极反应: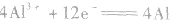
总反应:
与“金属材料是我们使用最广泛的一种材料,从古代到现代,金属材...”考查相似的试题有:
- 储氢纳米碳管的成功研制体现了科技的进步。用电弧法合成的碳纳米管常伴有大量的杂质——碳纳米颗粒。这种碳纳米颗粒可用氧化气...
- 在4Zn+10HNO3=4Zn(NO3)2+NH4NO3+3H2O的反应中,被还原的硝酸与未被还原的硝酸的物质的量比为( )A.1∶9B.9∶1C.4∶2D.2∶4
- (14分)某经济开发区将钛冶炼厂与氯碱厂、甲醇厂组成了一个产业链(如图所示),大大地提高了资源利用率,减少了环境污染。...
- 在3S + 6KOH = 2K2S + K2SO3+ 3H2O 反应中,做氧化剂的S原子与做还原剂的S原子的物质的量之比是( )A.1:2B.2:1C.1:3D.3:1
- 用下列方法制取O2: ①KClO3(MnO2), 受热分解, ②Na2O2加水, ③H2O2中加入MnO2, ④加热KMnO4, 若制得相同质量的氧气, 上述反应各物...
- 水热法制备Fe(FeO2)2纳米颗粒的反应3Fe2++2S2O32-+O2+xOH-=Fe(FeO2)2+S4O62-+2H2O下列说法中不正确的是A.每生成1mol Fe(FeO...
- 反应①、②分别是从海藻灰和智利硝石中提取碘的主要反应:①2NaI+MnO2+3H2SO4=2NaHSO4+MnSO4+2H2O+I2②2NaIO3+5NaHSO3=2Na2SO4+3N...
- 汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3= K2O+5Na2O+16N2↑。若氧化产物比还原产物多1.75mol,则下列判断正确的是( ...
- 复合材料的使用使导弹的射程有了很大的提高,其主要原因在于( )A.复合材料的使用可以使导弹能经受超高温的变化B.复合材料的...
- 为了增加汽车轮胎的耐磨性,常在轮胎的橡胶中加入的耐磨物质是 A.石墨粉B.活性炭C.炭黑D.木炭粉