本试题 “请回答下列有关硫酸知识的问题:(1)实验室用浓硫酸(溶质质量分数为98%,密度为1.84g/cm3)配制300g溶质质量分数11%的稀硫酸.(结果保留一位小数)a计算:...” 主要考查您对溶液的配制
复分解反应
酸的性质
中和反应及在实际中的应用
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 溶液的配制
- 复分解反应
- 酸的性质
- 中和反应及在实际中的应用
知识梳理:
1 、固体 + 水
①实验步骤:计算—称量—量取—溶解
②实验器材:托盘天平 + 药匙(或镊子) ;合适的量筒 + 胶头滴管;烧杯 + 玻璃棒
③注意事项:计算、称量和量取都要准确,溶解时固体要溶解完全
2 、液体 + 水
①实验步骤:计算—量取—溶解
②实验器材:合适的量筒 + 胶头滴管;烧杯 + 玻璃棒
③注意事项:计算、量取都要准确,同时需要两种不同规格的量筒
配制溶液的步骤:
(1)用溶质和水配制一定溶质质量分数的溶液
①实验用品:托盘天平、烧杯、量筒、胶头滴管、玻璃棒、药匙等。
②实验步骤:
计算→称量药品→量取水→搅拌溶解
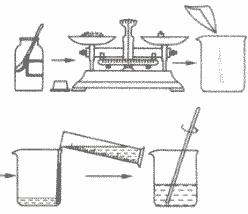
a.计算所需溶质和水的质量;
b.用托盘天平称量所需溶质,倒入烧杯中;
c.把水的密度近似看作1g/cm3,用量筒量取一定体积的水,倒入盛有溶质的烧杯里,用玻璃棒搅拌,使溶质溶解;
d.把配好的溶液装入试剂瓶中,盖好瓶塞并贴上标签(标签中应包括药品的名称和溶液中溶质的质量分数),放到试剂柜中。
③导致溶液质量分数变化的因素
a.称量时物质和砝码的位置放错,如止确称量5.8gNaCl,应在右盘放置5g砝码,再用0.8g游码,若放错位置,将砝码放在天平的左盘,则实际称量NaCl的质量为5g-0.8g=4.2g,这样会导致配制的溶液溶质质量分数变小;
b.量筒量取水的体积时读取示数错误,读取示数时仰视读数所量取水的实际体积大于理论值,将会使配制的溶液溶质质量分数变小;读取示数时俯视读数所量取水的实际体积小于理论值,将会使配制的溶液溶质质量分数变大;
c.将量筒中的水倒入烧杯时洒落到外面或未倒净,将导致溶液溶质质最分数偏大;
d.所用固体不纯,将会导致溶液溶质质量分数偏小;
e.计算错误可能会导致溶液溶质质量分数偏大或偏小。
配制溶液时导致溶质质量分数变化的原因:
在配制一定质量和一定质量分数的溶液过程中,经常会出现所得溶液溶质质量分数偏大或偏小的情况。
1. 所配溶液溶质质量分数偏小的原因:
①从计算错误角度考虑:水的质量算多了,溶质的质量算少了;
②从用托盘大平称量的角度考虑:天平读数有问题。药品和砝码放颠倒了,左盘放纸片但右盘没有放纸片,调零时,游码未拨回“0”刻度等;
③从用量筒量取液体的角度考虑:量取溶剂时,仰视读数了;
④从转移药品角度考虑:烧杯不干燥或烧杯内有水,量筒中的液体溶质未全部倒人烧杯中;
⑤从药品的纯度角度考虑:溶质中含有杂质
2. 所配溶液溶质质量分数偏大的原因
①称量时,所用砝码已生锈或沾有油污;②量取溶剂时,俯视读数了。
综合配制溶液的计算利用:
所提供的信息可选取多种方案配制所需的溶液。如现有KCl固体、蒸馏水、5%的KCl溶液、15%的KCl溶液,配制100g10%的KCl溶液,其方案有:
| 所需药品 | 主要步骤 | |
| 一 | 10gKCl+90g蒸馏水 | 用天平称量10gKCl,用量筒量取90ml水,分别倒入烧杯,用玻璃棒搅拌至KCl固体全部消失 |
| 二 | 66.7g15%的KCl溶液33.3g蒸馏水 | 用量筒量取33.3mL水,用天平称66.7g15%的KCl溶液,混合均匀即可 |
| 三 | 5.3gKCl+94.7g 5%的KCl溶液 | 用天平称量5.3gKCl固体和94.7g 5%的KCl溶液,将5.3gKCl倒入94.7g5%的KCl溶液中,用玻璃棒搅拌至KCl固体全部消失 |
| 四 | 50g5%KCl溶液+50g15%KCl 溶液 | 用天平称量5%、15%的KCl溶液各50g,混合均匀即可 |
复分解反应:
(1)概念:两种化合物互相交换成分,生成另外两种化合物的反应,形如AB+CD==AD+CB
(2)特点:
①一般在水溶液里进行,两种化合物中的离子互换。
②元素的化合价不改变。
(3)复分解反应的实质:复分解反应从微观角度看,是反应物之间相互交换离子,阴、阳离子重新结合生成沉淀或气体或水。如酸与碱发生中和反应的实质为:H++OH-==H2O。
复分解反应发生的条件:
常见的复分解反应:
①常见的有沉淀生成的复分解反应
Na2CO3+Ca(OH)2=CaCO3+2NaOH
CuSO4+2NaOH==Cu(OH)2↓+Na2SO4
FeCl3+3NaOH==Fe(OH)3↓+3NaCl
NaCl+AgNO3==AgCl↓+NaNO3
H2SO4+BaCl2==BaSO4↓+2HCl
②常见的有气休生成的复分解反应
CaCO3+2HCl==CaCl2+H2O+CO2↑
2NH4Cl+Ca(OH)2==CaCl2+2NH3↑+2H2O
③常见的有水生成的复分解反应
NaOH+HCl==NaCl+H2O
Na2CO3+HCl==NaCl+H2O+CO2↑
易错点:
例如CO2+Ca(OH)2====CaCO3↓+H2O这样的反应不是复分解反应。因为,根据复分解反应的定义。只有两种化合物互相交换成分,生成两种新的化合物的反应才是复分解反应。如:H2SO4+BaCl2====BaSO4↓+2HCl这个反应中,硫酸的成分(氢离子和硫酸根离子)与氯化钡的成分(氯离子和钡离子)互相交换,形成了硫酸钡和盐酸。而CO2+Ca(OH)2==CaCO3↓+H2O反应中二氧化碳的成分(C和O2)并没有与氢氧化钙的成分(钙离子和氢氧根离子)互相交换,所以这样的反应不是复分解反应。同理,CO2+2NaOH==Na2CO3+H2O和SO2+2NaOH===Na2SO3+H2O之类的反应也不是复分解反应。
(1)概念:两种化合物互相交换成分,生成另外两种化合物的反应,形如AB+CD==AD+CB
(2)特点:
①一般在水溶液里进行,两种化合物中的离子互换。
②元素的化合价不改变。
(3)复分解反应的实质:复分解反应从微观角度看,是反应物之间相互交换离子,阴、阳离子重新结合生成沉淀或气体或水。如酸与碱发生中和反应的实质为:H++OH-==H2O。
复分解反应发生的条件:
| 规律 | 发生的条件 |
| 金属氧化物+酸 | 生成物中有水,一般都能反应 |
| 酸+碱→盐+水 | 中和反应,有水生成,一般都能反应 |
| 酸+盐→新酸+新盐 | 生成物种有沉淀,气体或水 |
| 碱+盐→新碱+新盐 | 生成物种有沉淀,气体或水 |
| 盐1+盐2→新盐1+新盐2 | 生成物种有沉淀 |
常见的复分解反应:
①常见的有沉淀生成的复分解反应
Na2CO3+Ca(OH)2=CaCO3+2NaOH
CuSO4+2NaOH==Cu(OH)2↓+Na2SO4
FeCl3+3NaOH==Fe(OH)3↓+3NaCl
NaCl+AgNO3==AgCl↓+NaNO3
H2SO4+BaCl2==BaSO4↓+2HCl
②常见的有气休生成的复分解反应
CaCO3+2HCl==CaCl2+H2O+CO2↑
2NH4Cl+Ca(OH)2==CaCl2+2NH3↑+2H2O
③常见的有水生成的复分解反应
NaOH+HCl==NaCl+H2O
Na2CO3+HCl==NaCl+H2O+CO2↑
易错点:
例如CO2+Ca(OH)2====CaCO3↓+H2O这样的反应不是复分解反应。因为,根据复分解反应的定义。只有两种化合物互相交换成分,生成两种新的化合物的反应才是复分解反应。如:H2SO4+BaCl2====BaSO4↓+2HCl这个反应中,硫酸的成分(氢离子和硫酸根离子)与氯化钡的成分(氯离子和钡离子)互相交换,形成了硫酸钡和盐酸。而CO2+Ca(OH)2==CaCO3↓+H2O反应中二氧化碳的成分(C和O2)并没有与氢氧化钙的成分(钙离子和氢氧根离子)互相交换,所以这样的反应不是复分解反应。同理,CO2+2NaOH==Na2CO3+H2O和SO2+2NaOH===Na2SO3+H2O之类的反应也不是复分解反应。
定义:
化学上是指在溶液中电离时阳离子完全是氢离子的化合物。
酸的通性:
(1)跟指示剂反应 紫色石蕊试液遇酸变红色无色酚酞试液遇酸不变色
(2)跟活泼金属(金属活动性顺序表中比氢强的金属)发生置换反应酸+金属=盐+氢气 例:2HCl+Fe=FeCl2+H2↑
(3)跟碱性氧化物反应酸+碱性氧化物→盐+水 3H2SO4+Fe2O3=Fe2(SO4)3+3H2O
(4)跟某些盐反应酸+盐→新酸+新盐 H2SO4+BaCl2=2HCl+BaSO4↓
(5)跟可溶性碱发生中和反应酸+碱→盐+水 2HCl+Ba(OH)2=BaCl2+2H2O
常见酸的性质:
(1)盐酸是氯化氢的水溶液,是一种混合物。纯净的盐酸是无色的液体,有刺激性气味。
工业浓盐酸因含有杂质(Fe3+)带有黄色。浓盐酸具有挥发性,打开浓盐酸的瓶盖在瓶口
立即产生白色酸雾。这是因为从浓盐酸中挥发出来的氯化氢气体跟空气中水蒸汽接触,形
成盐酸小液滴分散在空气中形成酸雾。
(2)硫酸是一种含氧酸,对应的酸酐是SO3。纯净的硫酸是没有颜色、粘稠、油状的液体,不易挥发。稀H2SO4具有酸的通性。浓硫酸除去具有酸的通性外,还具有三大特性:
①吸水性: 浓H2SO4吸收水形成水合硫酸分子(H2SO4·nH2O),并放出大量热,所以浓硫酸通常用作干燥剂。
②脱水剂: 浓硫酸可将有机化合物中的氢原子和氧原子按水分子的构成(H:O=2:1)夺取而使有机物脱水碳化。纸、木柴、衣服等遇浓硫酸变黑,这就是因为浓硫酸的脱水性使其碳化的缘故。
③强氧化性:
在浓硫酸溶液中大量存在的是H2SO4分子而不是H+,H2SO4分子具强氧化性。
浓硫酸可使金属活动性顺序表氢后面的一些金属溶解,可将C、S等非金属单质氧化,而浓硫酸本身还原成SO2。但是,冷的浓硫酸不能与较活泼的金属Fe和Al反应。原因是浓硫酸可以使Fe和Al的表面形成一层致密的氧化物薄膜,阻止了里面的金属与浓硫酸继续反应,这种现象在化学上叫钝化。由于浓硫酸有脱水性和强氧化性,我们往蔗糖上滴加浓硫酸,会看到蔗糖变黑并且体积膨胀。又由于浓硫酸有吸水性,浓盐酸有挥发性,所以,往浓盐酸中滴加浓硫酸会产生大量酸雾,可用此法制得氯化氢气体。
(3)硝酸也是一种含氧酸,对应的酸酐是N2O5,而不是NO2。
纯净的硝酸是无色的液体,具有刺激性气味,能挥发。打开浓硝酸的瓶盖在瓶口会产生白色酸雾。浓硝酸通常带黄色,而且硝酸越浓,颜色越深。这是因为硝酸具有不稳定性,光照或受热时分解产生红棕色的NO2气体,NO2又溶于硝酸溶液中而呈黄色。所以,实验室保存硝酸时要用棕色(避光)玻璃试剂瓶,贮存在黑暗低温的地方。硝酸又有很强的腐蚀性,保存硝酸的试剂瓶不能用橡胶塞,只能用玻璃塞。
硝酸除具有酸的通性外,不管是稀硝酸还是浓硝酸都具有强氧化性。硝酸能溶解除金和铂以外的所有金属。金属与硝酸反应时,金属被氧化成高价硝酸盐,浓硝酸还原成NO2,稀硝酸还原成NO。但是,不管是稀硝酸还是浓硝酸,与金属反应时都没有氢气产生。较活泼的金属铁和铝可在冷浓硝酸中钝化,冷浓硝酸同样可用铝槽车和铁罐车运输和贮存。硝酸不仅能氧化金属,也可氧化C、S、P等非金属。
浓H2SO4为什么能做干燥剂:
因为浓H2SO4有强烈的吸水性,当它遇到水分子后,能强烈地和水分子结合,生成一系列水合物。这些水合物很稳定,不易分解,所以浓H2SO4是一种很好的干燥剂,能吸收多种气体中的水蒸气,实验室常用来干燥酸性或中性气体。如:CO2,SO2,H2,O2可用浓H2SO4干燥,但碱性气体如:NH3不能用浓H2SO4来干燥。
为什么浓H2SO4能用铁槽来运输:
当铁在常温下和浓H2SO4接触时,它的表面能生成一层致密的氧化膜,这层氧化膜能阻止浓H2SO4;对铁的进一步腐蚀,这种现象叫钝化。
活泼金属能置换出浓H2SO4中的氢吗?
稀H2SO4具有酸的通性,活泼金属能置换出酸中的氢。而浓H2SO4和稀H2SO4的性质不同,活泼金属与浓H2SO4反应时,不能生成氢气,只能生成水和其他物质,因为它具有强氧化性。
敞口放置的浓硫酸.浓盐酸.浓硝酸的变化:
胃酸:
在人的胃液里,HCl的溶质质最分数为0.45%— 0.6%,胃酸是由胃底腺的壁细胞分泌的。它具有以下功能:
(1)促进胃蛋白酶的催化作用,使蛋白质在人体内容易被消化,吸收;(2)使二糖类物质如蔗糖、麦芽糖水解;(3)杀菌。
酸的分类和命名
1.酸根据组成中是否含氧元素可以分为含氧酸和无氧酸。如:盐酸(HCl)属于无氧酸,硫酸(H2SO4)、硝酸(HNO3)属于含氧酸。
2.酸还可以根据每个酸分子电离出的H+个数,分为一元酸、二元酸、多元酸。如:每分子盐酸、硝酸溶于水时能电离出一个H+,属于一元酸;每分子硫酸溶于水时能电离出两个H+,属于二元酸。
3.无氧酸一般从前往后读作“氢某酸”。如:HCl读作氢氯酸(盐酸是其俗名),H2S读作氢硫酸。
4.含氧酸命名时一般去掉氢、氧两种元素,读作 “某”酸。如:H2SO4命名时去掉氢、氧两种元素,读作硫酸,H3PO4读作磷酸。若同一种元素有可变价态,一般低价叫“亚某酸”。如:H2SO3读作亚硫酸,HNO2读作亚硝酸。
化学上是指在溶液中电离时阳离子完全是氢离子的化合物。
酸的通性:
(1)跟指示剂反应 紫色石蕊试液遇酸变红色无色酚酞试液遇酸不变色
(2)跟活泼金属(金属活动性顺序表中比氢强的金属)发生置换反应酸+金属=盐+氢气 例:2HCl+Fe=FeCl2+H2↑
(3)跟碱性氧化物反应酸+碱性氧化物→盐+水 3H2SO4+Fe2O3=Fe2(SO4)3+3H2O
(4)跟某些盐反应酸+盐→新酸+新盐 H2SO4+BaCl2=2HCl+BaSO4↓
(5)跟可溶性碱发生中和反应酸+碱→盐+水 2HCl+Ba(OH)2=BaCl2+2H2O
常见酸的性质:
(1)盐酸是氯化氢的水溶液,是一种混合物。纯净的盐酸是无色的液体,有刺激性气味。
工业浓盐酸因含有杂质(Fe3+)带有黄色。浓盐酸具有挥发性,打开浓盐酸的瓶盖在瓶口
立即产生白色酸雾。这是因为从浓盐酸中挥发出来的氯化氢气体跟空气中水蒸汽接触,形
成盐酸小液滴分散在空气中形成酸雾。
(2)硫酸是一种含氧酸,对应的酸酐是SO3。纯净的硫酸是没有颜色、粘稠、油状的液体,不易挥发。稀H2SO4具有酸的通性。浓硫酸除去具有酸的通性外,还具有三大特性:
①吸水性: 浓H2SO4吸收水形成水合硫酸分子(H2SO4·nH2O),并放出大量热,所以浓硫酸通常用作干燥剂。
②脱水剂: 浓硫酸可将有机化合物中的氢原子和氧原子按水分子的构成(H:O=2:1)夺取而使有机物脱水碳化。纸、木柴、衣服等遇浓硫酸变黑,这就是因为浓硫酸的脱水性使其碳化的缘故。
③强氧化性:
在浓硫酸溶液中大量存在的是H2SO4分子而不是H+,H2SO4分子具强氧化性。
浓硫酸可使金属活动性顺序表氢后面的一些金属溶解,可将C、S等非金属单质氧化,而浓硫酸本身还原成SO2。但是,冷的浓硫酸不能与较活泼的金属Fe和Al反应。原因是浓硫酸可以使Fe和Al的表面形成一层致密的氧化物薄膜,阻止了里面的金属与浓硫酸继续反应,这种现象在化学上叫钝化。由于浓硫酸有脱水性和强氧化性,我们往蔗糖上滴加浓硫酸,会看到蔗糖变黑并且体积膨胀。又由于浓硫酸有吸水性,浓盐酸有挥发性,所以,往浓盐酸中滴加浓硫酸会产生大量酸雾,可用此法制得氯化氢气体。
(3)硝酸也是一种含氧酸,对应的酸酐是N2O5,而不是NO2。
纯净的硝酸是无色的液体,具有刺激性气味,能挥发。打开浓硝酸的瓶盖在瓶口会产生白色酸雾。浓硝酸通常带黄色,而且硝酸越浓,颜色越深。这是因为硝酸具有不稳定性,光照或受热时分解产生红棕色的NO2气体,NO2又溶于硝酸溶液中而呈黄色。所以,实验室保存硝酸时要用棕色(避光)玻璃试剂瓶,贮存在黑暗低温的地方。硝酸又有很强的腐蚀性,保存硝酸的试剂瓶不能用橡胶塞,只能用玻璃塞。
硝酸除具有酸的通性外,不管是稀硝酸还是浓硝酸都具有强氧化性。硝酸能溶解除金和铂以外的所有金属。金属与硝酸反应时,金属被氧化成高价硝酸盐,浓硝酸还原成NO2,稀硝酸还原成NO。但是,不管是稀硝酸还是浓硝酸,与金属反应时都没有氢气产生。较活泼的金属铁和铝可在冷浓硝酸中钝化,冷浓硝酸同样可用铝槽车和铁罐车运输和贮存。硝酸不仅能氧化金属,也可氧化C、S、P等非金属。
浓H2SO4为什么能做干燥剂:
因为浓H2SO4有强烈的吸水性,当它遇到水分子后,能强烈地和水分子结合,生成一系列水合物。这些水合物很稳定,不易分解,所以浓H2SO4是一种很好的干燥剂,能吸收多种气体中的水蒸气,实验室常用来干燥酸性或中性气体。如:CO2,SO2,H2,O2可用浓H2SO4干燥,但碱性气体如:NH3不能用浓H2SO4来干燥。
为什么浓H2SO4能用铁槽来运输:
当铁在常温下和浓H2SO4接触时,它的表面能生成一层致密的氧化膜,这层氧化膜能阻止浓H2SO4;对铁的进一步腐蚀,这种现象叫钝化。
活泼金属能置换出浓H2SO4中的氢吗?
稀H2SO4具有酸的通性,活泼金属能置换出酸中的氢。而浓H2SO4和稀H2SO4的性质不同,活泼金属与浓H2SO4反应时,不能生成氢气,只能生成水和其他物质,因为它具有强氧化性。
敞口放置的浓硫酸.浓盐酸.浓硝酸的变化:
| 酸的名称 | |||||
| 浓盐酸 | 挥发性 | 变小 | 不变 | 变小 | 变小 |
| 浓硫酸 | 挥发性 | 变小 | 不变 | 变小 | 变小 |
| 浓硝酸 | 吸水性 | 不变 | 变大 | 变大 | 变小 |
胃酸:
在人的胃液里,HCl的溶质质最分数为0.45%— 0.6%,胃酸是由胃底腺的壁细胞分泌的。它具有以下功能:
(1)促进胃蛋白酶的催化作用,使蛋白质在人体内容易被消化,吸收;(2)使二糖类物质如蔗糖、麦芽糖水解;(3)杀菌。
酸的分类和命名
1.酸根据组成中是否含氧元素可以分为含氧酸和无氧酸。如:盐酸(HCl)属于无氧酸,硫酸(H2SO4)、硝酸(HNO3)属于含氧酸。
2.酸还可以根据每个酸分子电离出的H+个数,分为一元酸、二元酸、多元酸。如:每分子盐酸、硝酸溶于水时能电离出一个H+,属于一元酸;每分子硫酸溶于水时能电离出两个H+,属于二元酸。
3.无氧酸一般从前往后读作“氢某酸”。如:HCl读作氢氯酸(盐酸是其俗名),H2S读作氢硫酸。
4.含氧酸命名时一般去掉氢、氧两种元素,读作 “某”酸。如:H2SO4命名时去掉氢、氧两种元素,读作硫酸,H3PO4读作磷酸。若同一种元素有可变价态,一般低价叫“亚某酸”。如:H2SO3读作亚硫酸,HNO2读作亚硝酸。
中和反应:
(1)定义:酸跟碱作用生成盐和水的反应,叫做中和反应。
(2)实质:酸中的氢离子与碱中的氢氧根离子作用生成水的过程。
概念理解:
①中和反应一定生成盐和水,但生成盐和水的反应不一定是中和反应。如Fe2O3+6HCl==2FeCl3+3H2O不是中和反应
②中和反应一定是复分解反应,但复分解反应不一定是中和反应。二者的关系是复分解反应包含了中和反应。
探究中和反应是否发生的方法:
酸与碱作用生成盐和水的反应叫中和反应,中和反应一般情况下没有明显的外观现象【H2SO4+ Ba(OH)2==BaSO4↓+2H2O除外】。
探究酸碱发生中和反应的方法有以下几种(以HCl和NaOH反应为例):
1. 指示剂法。先在NaOH溶液中滴加几滴酚酞溶液,溶液显红色,然后再滴加盐酸,观察到红色逐渐消失,则证明NaOH溶液与稀盐酸发生了化学反应。
2. pH试纸法。先用pH试纸测定NaOH溶液的pH,再滴加盐酸,并不断振荡溶液,同时多次测定混合溶液的pH。如果测得pH逐渐变小且小于7,则证明 NaOH溶液与稀盐酸发生了化学反应。
3. 热量变化法。化学反应通常伴随着能量的变化.所以可借助反应前后的温度变化来判断反应的发生。如果NaOH溶液与稀盐酸混合前后温度有变化,则证明发生了化学反应。
中和反应的应用:
①改变土壤的酸碱性根据土壤情况,可以利用中和反应,在土壤中加人适量酸性或碱性物质,调节土壤的酸碱性,以利于植物生长。如:近年来由于空气污染造成的酸雨,导致一些地方的土壤显酸性,不利于农作物生长,人们通常向土壤中撒适量熟石灰中和其酸性。
②处理工厂的废水工厂里排出的废水有一些显酸性或碱性,直接排放会对水体和环境造成污染。通常在排出的废水中加入适量的碱性或酸性物质中和。如:废水中含有硫酸可向其中加人适从熟石灰,反应的化学方程式为:H2SO4+Ca(OH)2==CaSO4+2H2O。
③用于医药人体胃酸(主要成分是盐酸)过多,会造成消化不良,甚至会产生胃病,通常服用呈碱性的物质来消除症状,如氢氧化铝,反应的化学方程式为:3HCl+Al(OH)3== AlCl3+3H2O。被蚊虫叮咬(蚊虫能分泌出蚁酸)后,可在患处涂上显碱胜的物质,如:NH3·H2O。
(1)定义:酸跟碱作用生成盐和水的反应,叫做中和反应。
(2)实质:酸中的氢离子与碱中的氢氧根离子作用生成水的过程。
概念理解:
①中和反应一定生成盐和水,但生成盐和水的反应不一定是中和反应。如Fe2O3+6HCl==2FeCl3+3H2O不是中和反应
②中和反应一定是复分解反应,但复分解反应不一定是中和反应。二者的关系是复分解反应包含了中和反应。
探究中和反应是否发生的方法:
酸与碱作用生成盐和水的反应叫中和反应,中和反应一般情况下没有明显的外观现象【H2SO4+ Ba(OH)2==BaSO4↓+2H2O除外】。
探究酸碱发生中和反应的方法有以下几种(以HCl和NaOH反应为例):
1. 指示剂法。先在NaOH溶液中滴加几滴酚酞溶液,溶液显红色,然后再滴加盐酸,观察到红色逐渐消失,则证明NaOH溶液与稀盐酸发生了化学反应。
2. pH试纸法。先用pH试纸测定NaOH溶液的pH,再滴加盐酸,并不断振荡溶液,同时多次测定混合溶液的pH。如果测得pH逐渐变小且小于7,则证明 NaOH溶液与稀盐酸发生了化学反应。
3. 热量变化法。化学反应通常伴随着能量的变化.所以可借助反应前后的温度变化来判断反应的发生。如果NaOH溶液与稀盐酸混合前后温度有变化,则证明发生了化学反应。
中和反应的应用:
①改变土壤的酸碱性根据土壤情况,可以利用中和反应,在土壤中加人适量酸性或碱性物质,调节土壤的酸碱性,以利于植物生长。如:近年来由于空气污染造成的酸雨,导致一些地方的土壤显酸性,不利于农作物生长,人们通常向土壤中撒适量熟石灰中和其酸性。
②处理工厂的废水工厂里排出的废水有一些显酸性或碱性,直接排放会对水体和环境造成污染。通常在排出的废水中加入适量的碱性或酸性物质中和。如:废水中含有硫酸可向其中加人适从熟石灰,反应的化学方程式为:H2SO4+Ca(OH)2==CaSO4+2H2O。
③用于医药人体胃酸(主要成分是盐酸)过多,会造成消化不良,甚至会产生胃病,通常服用呈碱性的物质来消除症状,如氢氧化铝,反应的化学方程式为:3HCl+Al(OH)3== AlCl3+3H2O。被蚊虫叮咬(蚊虫能分泌出蚁酸)后,可在患处涂上显碱胜的物质,如:NH3·H2O。
发现相似题
与“请回答下列有关硫酸知识的问题:(1)实验室用浓硫酸(溶质质...”考查相似的试题有:
- 实验室用氯化钾固体配制一定溶质质量分数的氯化钾溶液时,下列仪器中不需用到的是[ ]A、漏斗B、烧杯C、量筒D、托盘天平
- 在酸、碱、盐、氧化物中许多物质相互反应生成盐类物质,如图①②③④组合中都能生成盐类物质.根据表中提供信息,完成下列问题....
- 下列化学反应中,属于化合反应的是( )A.H2CO3═H2O+CO2↑B.CaO+H2O═Ca(OH)2C.2Al+3CuSO4═3Cu+Al2(SO4)3D.NaOH+HCl═Na...
- “波尔多液”能杀死葡萄.柑橘表皮的寄生虫,它是用硫酸铜溶液与石灰水混合而成的,其化学方程式为 ;若喷洒“波尔多液”不久就采...
- 下列物质的变化,通过加入盐酸溶液,不能一步实现的是( )A.Cu→CuCl2B.K2CO3→KClC.CaCO3→CaCl2D.Mg(OH)2→MgCl2
- 某兴趣小组的同学在学习完烧碱和纯碱的性质后进入实验室进行实验。小明在实验中却看到了一个不和谐的“音符”(如右图)。(1)...
- 饮用清天然矿泉水对人体健康有益,原因之一是矿泉水的pH与人体血液的pH相似。已知某种矿泉水的pH 为7.2-7.5,该矿泉水的酸碱...
- 在一定条件下,同一反应进行的快慢与反应物溶液中溶质的质量分数成正比,现用100克溶质质量分数为30%的硫酸溶液与过量的镁粉...
- 中和反应在日常生活和工农业生产中有广泛的应用,下列实例不属于中和反应在生活中的利用的是( )A.土壤酸化后加入熟石灰改...
- 化学来自生活,用于生活,下表列出生活中常用物质溶液的pH及一种主要成分(其他成分未列出)编号①②③④⑤名称食醋白酒白糖水石灰...