本试题 “将表面有少量氧化铜的铜片,和铁片同时加入足量稀盐酸中,经充分反应后,溶液中一定含有的金属离子是( )A.Fe2+B.Fe2+和Cu2+C.Fe3+和Cu2+D.Fe2+和Fe3+” 主要考查您对单质铁
单质铜
氧化亚铜
氧化铜
氢氧化铜
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 单质铁
- 单质铜
- 氧化亚铜
- 氧化铜
- 氢氧化铜
铁元素:
在元素周期表中的位置:铁的原子序数26,位于周期表中第四周期,第Ⅷ族。
(1)物理性质:银白色、有金属光泽,密度较大,熔点较高,硬度较小,具有导电、导热、延展性,可被磁铁吸引。
(2)化学性质:较活泼的金属,+2、+3价两种价态
①与强氧化剂反应(如:Cl2 Br2 过量稀HNO3)生成+3价铁的化合物。如: 
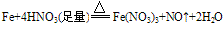
注:铁常温下在浓硫酸和浓硝酸中钝化,但加热可以反应,且被氧化成Fe3+
②与弱氧化剂反应(如S I2 H+ Cu2+)生成+2价铁的化合物,如: 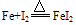
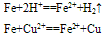
③铁与氧气、水蒸气反应生成Fe3O4(FeO·Fe2O3)

铁的性质:
- 物理性质:铁是黑色金属,具有铁磁性
- 铁的化学性质:
①与强氧化剂反应(如:Cl2、 Br2 、过量稀HNO3)生成+3价铁的化合物。如:
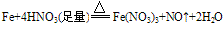
注:铁常温下在浓硫酸和浓硝酸中钝化,但加热可以反应,且被氧化成Fe3+
②与弱氧化剂反应(如S、 I2 、H+ 、Cu2+)生成+2价铁的化合物,如: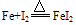
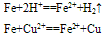
③铁与氧气、水蒸气反应生成Fe3O4(FeO·Fe2O3)

铁与稀硝酸的反应:
- 铁少量时:
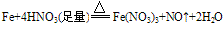
- 铁过量时:3Fe+8HNO3==3Fe(NO3)2+2NO+4H2O
两式可通过2Fe3++Fe==3Fe2+联系起来。
注意:
- 铁元素性质活泼,自然界中的铁元素几乎都是以化合态存在,只有在陨石中存在游离态的铁元素。
- 过量的铁与氯气反应,不会生成FeCl2,因为铁还原三价铁必须在水溶液中进行。
- 金属与强氧化性酸反应,不会生成H2。
化学性质:
铁元素性质活泼,有较强的还原性。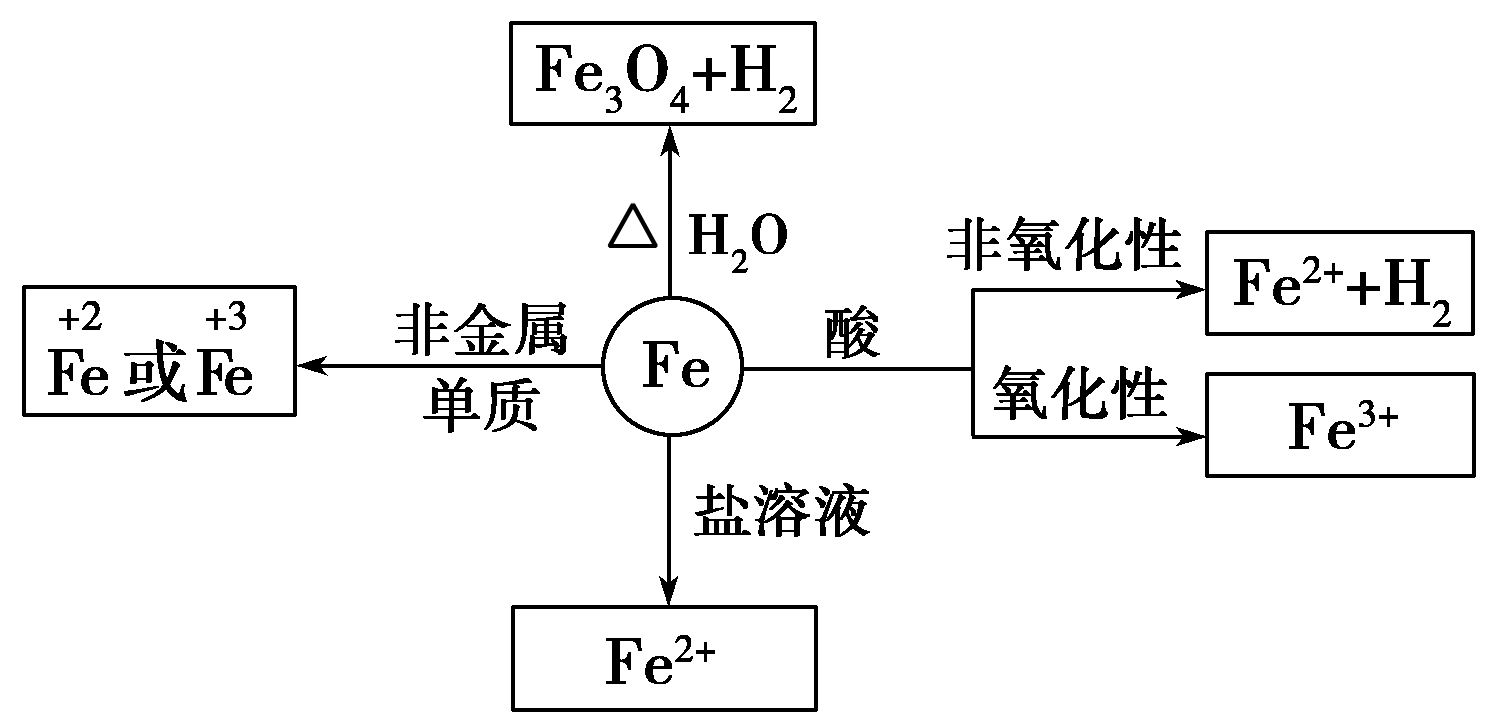
铁三角关系:

铜元素:
在元素周期表中的位置:铜的原子序数29,位于周期表中第四周期,第IB族。
(1)物理性质:有金属光泽,紫红色固体,密度较大,导电导热性能很好,具有很好的延展性,铜属于重金属、有色金属、常见金属,不能被磁铁吸引。
(2)化学性质: 铜常见的化合价为+1价和+2价
①在加热条件下,铜可与多种非金属单质反应。一般来说,遇到氧化性较弱的非金属,铜显较低化合价;遇到氧化性较强的非金属,铜显较高化合价。例如:与强氧化剂反应(如Cl2 Br2等)生成+2价铜的化合物。如:
Cu+Cl2 CuCl2 2Cu+O2
CuCl2 2Cu+O2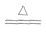 2CuO
2CuO
②铜与酸反应:铜只能被氧化性酸中的中心元素氧化。例如: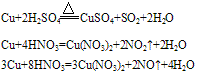
③铜与盐溶液反应:
Cu+2AgCl CuCl2+2Ag
CuCl2+2Ag
铜与铁的对比:
从金属活性顺序表:K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au可知,金属铁的金属活性比铜强,所以单质Fe可以从Cu的溶液中还原出单质来,例如: Fe+CuCl2 FeCl2+Cu
FeCl2+Cu
即Fe的还原性强于Cu
铜与浓硫酸和稀硫酸的反应:
Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
2Cu+O2+2H2SO4(稀) 2CuSO4+2H2O
2CuSO4+2H2O
注意:从金属活性顺序表:K Ca Na Mg Al Zn Fe Sn Pb (H)Cu Hg Ag Pt Au 可知,铜不能与稀硫酸发生反应,但是在有氧气和加热的条件下可以反应
铜与铜的化合物之间的转换图: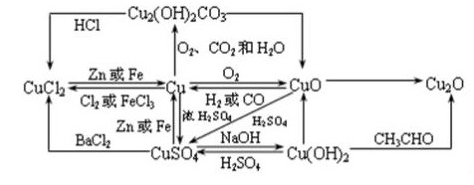
铜的制备和精炼:
(1)工业炼铜法:CuO+CO Cu+CO2
Cu+CO2
(2)湿法炼铜:Fe+CuSO4 FeSO4+Cu
FeSO4+Cu
(3)高温炼铜:工业上用高温冶炼黄铜矿的方法获得铜(粗铜):
2CuFeS2+4O2 Cu2S+3SO2+2FeO(炉渣)
Cu2S+3SO2+2FeO(炉渣)
2Cu2S+3O2 2Cu2O+2SO2
2Cu2O+2SO2
2Cu2O+Cu2S 6Cu+SO2↑
6Cu+SO2↑
备注:粗铜中铜的的含量为99.5%-99.7%,主要含有Ag、Zn、Au等杂质,粗铜通过电解精炼可得到纯度达99.95%-99.98%的铜,原理为用粗铜作阳极,失去电子变为Cu2+,用纯铜棒作阴极即可得精铜。
氧化亚铜:
氧化亚铜为红色或砖红色八面立方晶系结晶性粉末。相对密度6.0,熔点1235℃。在1800℃失去氧。不溶于水和醇,溶于盐酸、氯化铵、氨水,微溶于硝酸。
氧化亚铜的化学性质:
(1)溶于盐酸生成白色氯化亚铜结晶粉末。遇稀硫酸和稀硝酸生成铜盐。在空气中会迅速变蓝。能溶于浓碱、三氯化铁等溶液中。在湿空气中逐渐氧化成黑色氧化铜。
(2)不溶于水及有机溶剂,但可溶于浓氨溶液形成无色配合物[Cu(NH3)2]+,其在空气中被氧化为蓝色的[Cu(NH3)4(H2O)2]2+。氢卤酸反应,因生成络合物,不岐化成二价铜和铜,氧化亚铜氧化亚铜可溶于盐酸生成H[CuCl2](氯化亚铜的配合物),也可溶于硫酸及硝酸分别形成硫酸铜及硝酸铜。
知识点拨:
在酸性溶液中岐化为二价铜,说明在溶液中,二价铜离子的稳定性大于一价铜离子,例如氧化亚铜和硫酸反应,生成硫酸铜和铜。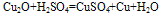
知识扩展:
氧化亚铜有剧毒,氧化亚铜粉尘在空气中含量达到0.22~14mg/m3时,工作1~2h后会引起急性中毒,表现为头痛、无力、咽和结膜发红、恶心、肌肉痛、有时呕吐和腹泻、疲乏、体温升高。一天以后体温可恢复正常,但仍无力,头痛,眩晕,脉数加快,淋巴细胞增多。氧化亚铜的慢性中毒表现为:接触铜化合物的工人的局部皮肤、头发及眼结膜有时变成浅黄色或黑绿色,齿龈上有暗红色或绛红色边。对皮肤有刺激作用,粉尘刺激眼睛,并引起角膜溃疡。对急性中毒者用一定浓度的K4[Fe(CN)6]溶液洗胃,服牛奶等措施。空气中最高容许浓度为0.1mg/m3。可戴口罩、防尘眼镜,穿防护工作服,工作后要洗淋浴。
氧化铜:
(1)物理性质:氧化铜是不溶于水的黑色固体(粉末),能溶于烯酸中,主要用于制造人造丝、陶瓷、釉、电池、杀虫剂,也用于制氢,做催化剂使用。
(2)化学性质:①氧化铜有金属氧化物的性质,常温下能与烯酸反应:CuO+2H+ Cu2++H2O
Cu2++H2O
②氧化铜具有氧化性,加热条件下可以与还原剂发生氧化还原反应:H2+CuO Cu+H2O
Cu+H2O
③氧化铜在高温下可发生分解反应:4CuO 2Cu2O+O2↑
2Cu2O+O2↑
(3)冶炼:一般通过加热分解Cu(OH)2的方式得到CuO,化学方程式为:Cu(OH)2 CuO+H2O
CuO+H2O
注意: 溶液中的Cu2+常为蓝色(浓CuCl2溶液呈绿色,稀CuCl2溶液呈蓝色),其颜色可作为Cu2+的判断依据。Cu2+与碱发生反应生成蓝色沉淀Cu(OH)2,其溶于氨水形成蓝色溶液。
氧化铜的特性:
| 气味 | 无味 |
| 颜色 | 黑色或者棕黑色 |
| 外观 | 无定形或结晶性粉末 |
| 性状 | 稍有吸湿性 |
| 相对质量 | 79.55 |
| 溶解性(水) | 不可溶 |
| 溶解度 | 不溶于水和乙醇,溶于酸、氯化铵及氰化钾溶液,氨溶液中缓慢溶解 |
| 稳定性 | 稳定 |
| 储存 | 密封干燥保存 |
| 用途 | 做有机反应的催化剂,制作人造丝和其他铜化合物等 |
氧化铜和氢氧化铜的性质比较:
名称
氧化铜
氢氧化铜
化学式
CuO
Cu(OH)2
物理性质
不溶水的黑色固体(粉末)
不溶于水的蓝色固体
化学性质
CuO+2H+
 Cu2++H2O
Cu2++H2O
CuO+H2 Cu+H2O
Cu+H2O
CuO+CO Cu+CO2
Cu+CO2Cu(OH)2+2H+  Cu2++2H2O
Cu2++2H2O
Cu(OH)2 CuO+H2O
CuO+H2O
Cu(OH)2+4NH3·H2O Cu(NH3)4(OH)2+4H2O
Cu(NH3)4(OH)2+4H2O
制法
Cu(OH)2
 CuO+H2O
CuO+H2OCu2++2OH-  Cu(OH)2↓
Cu(OH)2↓
例题:铜在自然界存在于多种矿石中,如:黄铜矿(CuFeS2)、斑铜矿(Cu5FeS4)、辉铜矿(Cu2S)、孔雀石(CuCO3·Cu(OH)2
请回答下列问题:
(1)、上表所列铜化合物中,铜的质量百分含量最高的是__Cu2S
)、工业上以黄铜矿为原料。采用火法熔炼工艺生产铜。改工艺的中间过程会发生反应:
2Cu2O+Cu2S 6Cu+SO2↑,反应的氧化剂是Cu2S和Cu2O
6Cu+SO2↑,反应的氧化剂是Cu2S和Cu2O
(3)、二氧化硫尾气直接排放到大气中造成环境污染的后果是形成酸雨,会对植物和建筑物等造成严重危害;该尾气可得到有价值的化学品,写出其中1中酸和1中盐的名称硫酸、硫酸钠。
(4)黄铜矿熔炼后得到的粗铜含少量Fe、Ag、Au等金属杂质,需要进一步采用电解法精制。请简述粗铜电解得到精铜的大批量:以硫酸铜-硫酸溶液为电解质。电解时,粗铜(阳极)中的铜以及比铜活泼的金属失去电子进入溶液,不如铜活泼的金属沉入电解槽形成“阳极泥”;溶液中的Cu2+得到电子沉积在纯铜(阴极)上。
氧化铜与铜化合物之间的转换图:
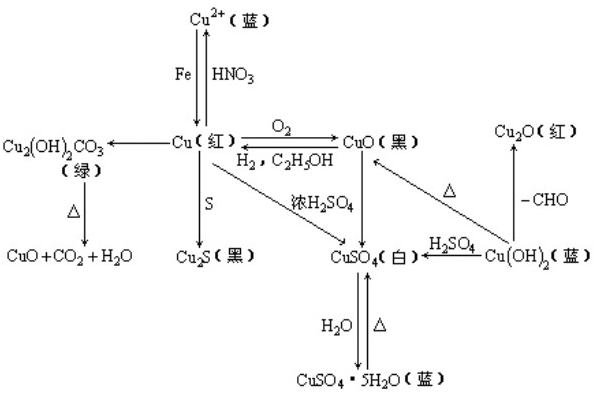
需要记住这些单质、化合物的颜色和状态,可以做为实验题的切入点。
知识扩展:
溶液中的Cu2+常为蓝色(浓CuCl2溶液呈绿色,稀CuCl2溶液呈蓝色),其颜色可作为Cu2+的判断依据。Cu2+与碱发生反应生成蓝色沉淀Cu(OH)2,其溶于氨水形成蓝色溶液。
反应方程为:CuCl2+2NaOH Cu(OH)2↓+2NaCl;Cu(OH)2+4NH3·H2O
Cu(OH)2↓+2NaCl;Cu(OH)2+4NH3·H2O Cu(NH3)4(OH)2+4H2O
Cu(NH3)4(OH)2+4H2O
氢氧化铜:
化学式Cu(OH)2,淡蓝色粉末状晶体,密度3.368g/cm3。难溶于水。受热易分解为氧化铜和水。微显两性,既溶于酸又溶于氨水和浓碱溶液。
氢氧化铜的物理性质和化学性质:
1.物理性质:不溶于水的蓝色固体
2.化学性质:Cu(OH)2+2H+==Cu2++2H2O;Cu(OH)2 CuO+H2O;Cu(OH)2+4NH3·H2O==Cu(NH3)4(OH)2+4H2O
CuO+H2O;Cu(OH)2+4NH3·H2O==Cu(NH3)4(OH)2+4H2O
知识点拨:
溶液中的Cu2+常为蓝色(浓CuCl2溶液呈绿色,稀CuCl2溶液呈蓝色),其颜色可作为Cu2+的判定依据。Cu2+与碱反应生成蓝色沉淀Cu(OH)2, Cu(OH)2溶于氨水形成深蓝色溶液。
与“将表面有少量氧化铜的铜片,和铁片同时加入足量稀盐酸中,经...”考查相似的试题有:
- 某校化学小组学生利用下图所列装置进行“铁与水反应”的实验,并利用产物进一步制取FeCl3·6H2O晶体。(图中夹持及尾气处理装置...
- 根据下图中的反应,写出各物质的化学式及①②③反应的化学方程式。(1)A是________,B是________,C是________,D是________。(2)...
- 某溶液中,滴入KSCN溶液时无明显现象,再滴入少量新制氯水,溶液立即变为血红色,则原溶液中一定含有的离子是( )A.Fe2+B...
- 氯化铁是常见的水处理剂。某氯化铁样品含有少量杂质。现要测定其中的质量分数,实验按以下步骤进行:已知有关离子方程式为:...
- 现有浓度分别为1 mol/L的FeCl3、FeCl2、CuCl2混合溶液100 mL,加入一定量的铁粉,按下列情况填空。(1)充分反应后,如果溶液中...
- 下列有关金属及化合物的说法正确的是A.地壳中含量最多的元素是铝元素;B.在自然界中铝以化合态存在;C.NaCl的焰色反应呈紫...
- 从废液FeCl3、FeCl2、CuCl2中回收Cu,同学们设计了如下方案:废液中加入过量的铁粉,过滤,向铁、铜混合物中加入足量的盐酸,...
- 将氢气通入10g灼热的氧化铜中,过一段时间后得到8.4g固体,下列说法正确的是( )A.有8.4g铜生成B.有8g氧化铜参加反应C.有1....
- Cu及其化合物之间相互转化常伴随着颜色的变化。下列符合黑色→红色变化的是( )A.Cu(OH)2→CuOB.Cu→Cu2SC.Cu2(OH)2CO3→CuOD....
- 将FeO、Fe2O、Fe3O4混合物均分成两等份,在相同条件下,一份用足量H2还原,参加反应H2的体积为V1,另一份用足量浓NHO3处理得N...